







《有机化学光谱分析PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为1.82 MB,总共有132页,格式为pptx。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 132页
- 1.82 MB
- VIP模板
- pptx
- 数字产品不支持退货
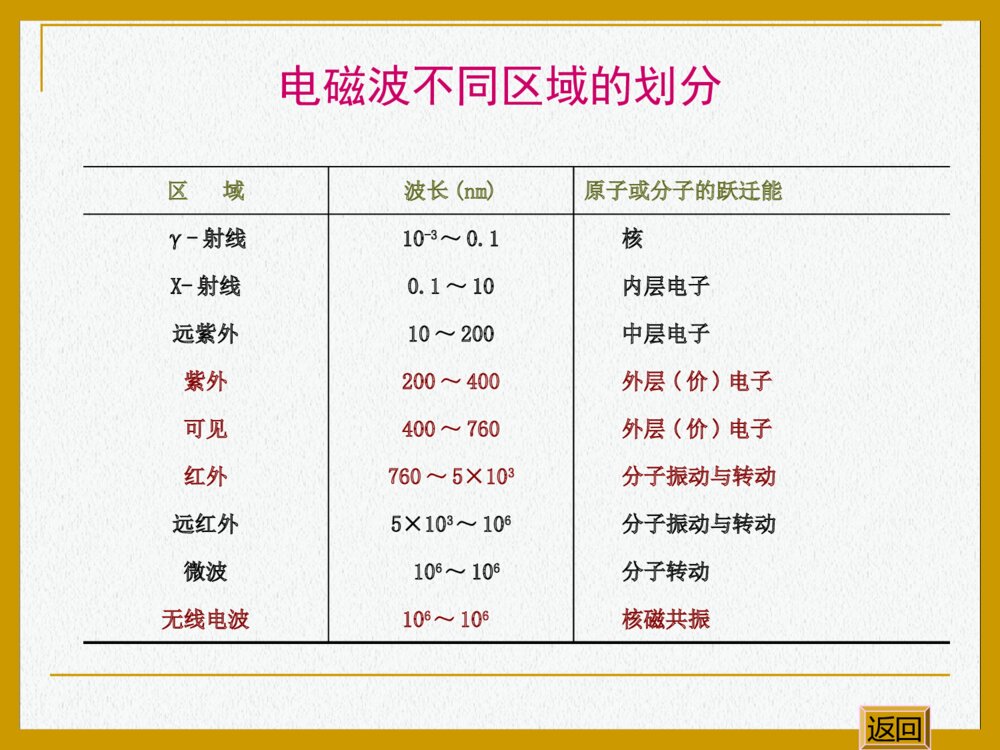
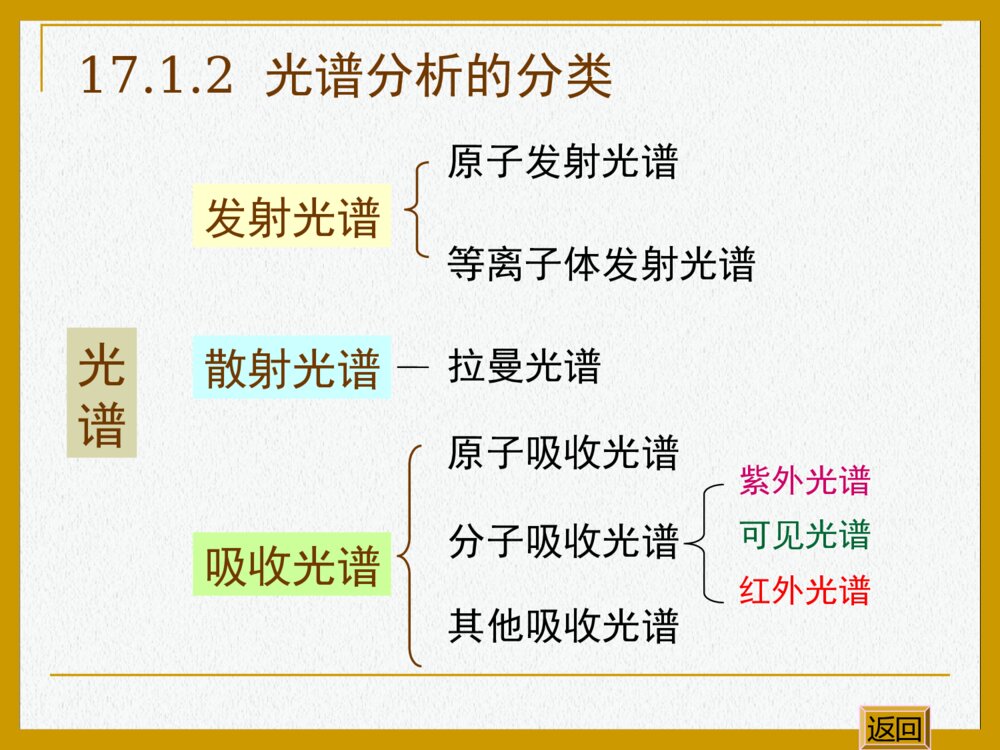
基本内容和重点要求分子吸收光谱的基本原理;紫外光谱原理及对有机分子结构的表征;红外光谱原理,分子振动模式及有机分子的基团特征频率,红外光谱对有机分子结构的表征;核磁共振谱原理,化学位移,自旋偶合与自旋裂分,1H-NMR谱对有机分子结构的表征重点要求掌握红外光谱和核磁共振谱原理及对有机分子结构的表征,运用光谱推测简单有机化合物的构造式。返回17光谱分析在有机化学中的应用17.1光谱分析概述17.2紫外光谱17.3红外光谱17.4核磁共振谱返回17.1光谱分析概述17.1.1光的基本性质17.1.2光谱分析的分类17.1.3吸收光谱原理17.1.4能量约束原理和选律返回λ为波长;ν为频率;c为光速(3×108m/s);为波数。17.1.1光的基本性质光具有波粒二象性¦光的波动性1=λ·ν=c光的粒子性返回()cEhhh为普朗克常数h=6.624×10-34J/s区域波长(nm)原子或分子的跃迁能γ-射线10-3~0.1核X-射线0.1~10内层电子远紫外10~200中层电子紫外200~400外层(价)电子可见400~760外层(价)电子红外760~5×103分子振动与转动远红外5×103~106分子振动与转动微波106~106分子转动无线电波106~106核磁共振电磁波不同区域的划分返回17.1.2光谱分析的分类光谱发射光谱散射光谱吸收光谱原子发射光谱等离子体发射光谱拉曼光谱原子吸收光谱分子吸收光谱其他吸收光谱紫外光谱可见光谱红外光谱返回17.1.3吸收光谱原理当电磁波照射物质时,物质可以吸收一部分辐射。吸收的辐射能量可以激发分子的电子(主要是外层价电子)跃迁到较高的能级或增加分子中原子的振动和转动能量。对某一分子来说,它只能吸收某些特定频率的辐射。因此,一个分子对于不同波长辐射的吸收,即对于具有不同频率(不同的光量子能量)的辐射的吸收是不一样的。如果把某一有机化合物对不同波长辐射的吸收情况记录下来,就成为这一化合物的吸收光谱。分子结构吸收光谱返回分子的吸收光谱的表示方法吸光度A-波长λ(或频率ν)曲线百分透过率T%-波长λ(或频率ν)曲线TIIAl1lglg0I0为入射光强度,Il为透过光的光强度0%100%lITI返回能量约束原理:能量恰好等于分子中某2个能级间的能量差的电磁波才有可能被分子吸收。17.1.4能量约束原理和选律选律:在满足能量约束原理的条件下,不是任意2个能级间都可以发生能级跃迁的,只有那些遵循跃迁规律的能级间才有可能发生能级跃迁。返回21()cEEEhhhc17.2紫外光谱17.2.1基本原理17.2.2紫外光谱与有机分子结构17.2.3紫外光谱在有机分子结构分析中的应用返回(UltravioletAbsorptionSpectroscopy)17.2.1基本原理真空紫外区普通紫外区可见光区100nm200nm400nm800nm(1)紫外光的波长范围返回(2)紫外光谱的产生ABABABσ*反键分子轨道σ成键分子轨道A、B原子轨道形成A-B分子σ轨道示意图返回A原子轨道σ*σB原子轨道UV光样品槽基态激发态E1-E0=hνA、B原子轨道形成A-B分子σ轨道示意图返回(3)紫外光谱的表示方法0lglIAclI物质对电磁辐射的吸收性质用吸收曲线来描述。溶液对单色光的吸收程度遵守Lambert-Beer定律:紫外光谱以波长λ(nm)为横坐标,以吸光系数ε或lgε为纵坐标来表示。A为吸光度I0为入射光强度Il为透过光的光强度ε为摩尔吸光系数c为溶液浓度(mol/L)l为样品槽厚度返回ε的大小表示这个分子在吸收峰的波长可以发生能量转移(电子从能位低的分子轨道跃迁到能位高的分子轨道)的可能性。ε值大于104:完全允许的跃迁ε值小于103:跃迁几率较低ε值小于几十:跃迁是禁阻的返回σ→σ*饱和烃类化合物CH4λmax125nmC2H6λmax135nm(≈150nm)在远紫外区吸收n→σ*含杂原子的饱和烃CH3OHλmax183nmCH3NH2λmax213nmCH3Clλmax173nm(≈200nm)在远、近紫外交界处吸收π→π*n→π*C=Cλmax162nmC=C-C=OC=C-C=Cλmax217nmC=C-NO2苯(≈200nm)(≈200~400nm)在近紫外区吸收17.2.2紫外光谱与有机分子结构返回由紫外线吸收引起的电子跃迁类型σσ*ππ*n△E电子跃迁的类型不同,实现跃迁所需的能量不同,跃迁能量越大,则吸收光的波长越短。各种跃迁所需的能量跃迁顺序为:σ→σ*>n→σ*>π→π*>n→π*返回基本术语生色团:产生紫外或可见吸收的不饱和基团,如C=C、C=O、NO2等。助色团:其本身是饱和基团(常含杂原子),它连到生色团上时,能使后者吸收波长变长或(和)吸收强度增加,如-OH、-NH2、Cl等。蓝移(blueshift)吸收峰向短波长方向移动红移(redshift)吸收峰向长波长方向移动增色效应使吸收强度增加的效应减色效应使吸收强度减小的效应返回17.2.3紫外光谱在有机分子结构分析中的应用紫外光谱主要用来判断含共轭体系、芳香结构和发色团的有机化合物。根据紫外光谱中特征的位置、吸收强度及变化规律来推断化合物结构。返回谱带波长范围能级跃迁ε表征的分子结构K200~250nmπ→π*n→π*>10000100~3000共轭分子含杂原子饱和基团(助)B250~300nmπ→π*≥50~3000芳香化合物R300nm以上n→π*<100含杂原子不饱和基团(生)E1180nmπ→π*>10000芳香化合物E2200nmπ→π*≥7000芳香化合物紫外光谱与有机分子结构返回例:已知一个有机化合物的UV谱有明显的B带吸收,但无精细结构;还有254nm(ε13000)强吸收和319nm(ε50)明显吸收。试问:该化合物是A还是B?COCH3COCH3AB返回17.3.1红外光谱法简介17.3.2红外光谱的基本原理17.3.3分子结构与红外光谱特征的吸收频率17.3.4各类化合物的红外光谱图17.3.5红外光谱在结构分析中的应用(InfraredAbsorptionSpectroscopy)17.3红外光谱(IR)返回(1)红外光谱法发展历程 50年代初期,商品红外光谱仪问世。 70年代中期,红外光谱已成为有机化合物结构鉴定的最重要的方法。 近十年来,傅里叶变换红外的问世以及一些新技术的出现,使红外光谱得到更加广泛的应用。17.3.1红外光谱法简介返回(2)红外光谱法的特点任何气态、液态、固态样品均可进行红外光谱测定;不同的化合物有不同的红外吸收,由红外光谱可得到化合物丰富的结构信息;常规红外光谱仪价格低廉;样品用量少;可针对特殊样品运用特殊的测试方法返回17.3.2红外光谱的基本原理红外光谱是分子吸收红外光引起振动和转动能级跃迁产生的吸收信号。λ(m)近红外中红外基团的振动吸收远红外0.7833030012820333333333σ(cm-1)红外光(0.76~1000μm)返回对称伸缩振动(1)分子的振动方式伸缩振动改变键长返回动画不对称伸缩振动伸缩振动改变键长返回动画平面箭式弯曲振动弯曲振动改变键角返回动画平面摇摆弯曲振动弯曲振动改变键角返回动画平面外摇摆弯曲振动弯曲振动改变键角返回动画平面外扭曲弯曲振动弯曲振动改变键角返回动画(2)红外光谱原理 上述振动虽然不改变极性分子中正、负电荷中心的电荷量,却改变着正、负电中心间的距离,导致分子偶极矩的变化。相应这种变化,分子中总是存在着不同的振动状态,有着不同的振动频率,因而形成不同的振动能级。能级间的能量差与红外光子的能量相当。返回 当一束连续波长的红外光透过极性分子材料时,某一波长的红外光的频率若与分子中某一原子或基团的振动频率相同时,即发生共振。这时,光子的能量通过分子偶极矩的变化传递给分子,导致分子对这一频率的光子的选择吸收,从振动基态激发到振动激发态,产生振动能级的跃迁。返回(3)红外光谱仪原理返回国产双光束比例记录红外分光光度计返回美国Nicolet公司AVATAR-360型FT-IR返回FT-IR仪的优点: 做样需要的时间很短,灵敏度高,分辨率高,同时利用计算机,可以用不同的方法对光谱进行处理。返回(4)红外光谱图 记录被吸收光子的频率(波数)或波长及相应的吸收强度,即形成IR谱图。IR谱一般以波数(cm-1)或波长λ(μm)为横坐标,以透光率T(%)为纵坐标,基团的吸收愈强则曲线愈向下降。返回红外光谱图返回分子的振动频率决定分子基团吸收的红外光频率,即红外吸收位置。2121mmmmK21KC21或K为双原子形成的化学键力常数m1和m2分别为质量两个原子相对原子振动频率与原子的质量化学键强度有关17.3.3分子结构与红外光谱特征的吸收频率返回氢键区:OH、NH、CH、SH等基团的伸缩振动单键区:各种单键的伸缩振动以及含氢基团的弯曲振动C=CC=OC=NC=SN=O以及苯基的伸缩振动官能团区C≡CC≡N等基团的伸缩振动400035003000200025001500400指纹区(1)红外光谱中官能团的特征吸收频率返回叁键区:双键区:4000-2500cm-1羟基:吸收在3200-3650cm-1范围。游离羟基吸收在较高波数,峰形尖锐。当缔合形成以氢键相连的多聚体时,键力常数下降,吸收位置移向较低波数,峰形宽而钝。返回4000-2500cm-1胺基:胺基的红外吸收与羟基类似,游离胺基的红外吸收在3300-3500cm-1范围,缔合后吸收位置降低约100cm-1。伯胺两个吸收峰,仲胺只有一个吸收峰,叔胺因氮上无氢,在此区域没有吸收。芳香仲胺吸收峰比相应的脂肪仲胺波数偏高。返回4000-2500cm-1烃基:不饱和碳(双键及苯环)的碳氢伸缩振动频率大于3000cm-1,饱和碳(三员环除外)的碳氢伸缩振动频率低于3000cm-1,叁键碳的碳氢吸收峰在3300cm-1,峰期锐。返回2500-2000cm-1叁键和累积双键的伸缩振动区,此区域内任何小的吸收峰都应引起注意,它们都能提供结构信息。双键的伸缩振动区,是红外谱图中很重要的区域。区域内最重要的是羰基的吸收。2000-1500cm-1返回(2)影响基团吸收频率位移的因素返回诱导效应共轭效应键的极性不同引起化学键力常数变化离域作用使键长平均化,单键力常数增加,双键力常数减小电子效应氢键的影响氢键的形成使参与形成氢键的原化学键的键力常数降低,吸收频率低波数方向。但振动时偶极矩的变化加大,吸收强度增加。诱导效应ORRCOClRCOBrRC1715cm-11785~1815cm-1~1812cm-1OFRC~1869cm-1返回共振效应ONH2RONH2RCC-+共振效应降低了羰基的双键性,吸收频率移向低波数。返回共轭效应ORRCOCHRCHCORC1715cm-11675cm-11690cm-1返回氢键的影响氢键的形成使参与形成氢键的原化学键的键力常数降低,吸收频率低波数方向。但振动时偶极矩的变化加大,吸收强度增加。例:醇的羟基:游离态二聚体多聚体3610-3640cm-13500-3600cm-13200-3400cm-1低波数返回17.3.4各类化合物的红外光谱图(1)烷烃(2)烯烃(3)炔烃(4)单环芳烃返回(5)醇(6)酚(7)醛和酮(8)羧酸及衍生物(9)胺(1)烷烃返回烷烃的主要吸收峰为2850~3000cm-1区域的伸缩振动。1450~1470cm-1剪式弯曲振动1370~1380cm-1、720~725cm-1平面摇摆弯曲振动正辛烷的红外光谱(2)烯烃C-H伸缩振动吸收大于3000cm-1,C=C键的伸缩振动在1600~1680cm-1。随着双键碳上烷基的增加,强度减弱。烯烃C-H键的平面外弯曲振动吸收可用于判断双键碳上的烷基取代类型。返回烯烃C-H键的平面外弯曲振动频率CCHHRHCCRHRHCCRHRRCCHHRRCCHRRHCCRRRR910cm-1,990cm-1675~725cm-1790~840cm-1890cm-1970cm-1无返回顺式烯烃返回顺-2,2,5,5-四甲基己烯红外光谱1670=C-H面外弯曲振动900反式烯烃返回反-2,2,5,5-四甲基己烯红外光谱末端烯烃返回14203-甲基-1-戊烯的红外光谱3040=C-H面外弯曲振动共轭烯烃返回16101,3,5-己三烯的红外光谱(3)炔烃≡C-H末端炔烃非末端炔烃伸缩振动3300cm-1无弯折振动600~700cm-1无C≡C伸缩振动2100~2140cm-12200~2260cm-1返回返回2-辛炔的红外光谱1-辛炔的红外光谱末端炔烃返回(4)单环芳烃芳环骨架的伸缩振动在1625~1575cm-1,1525~1475cm-1C-H伸缩振动在3100~3010cm-1返回苯取代物的C-H面外弯折振动770~735cm-1710~685cm-1760~745cm-1900~860cm-1790~770cm-1725~680cm-1830~800cm-1返回苯取代物的C-H面外弯折振动800~770cm-1720~685cm-1900~860cm-1860~800cm-1900~860cm-1865~810cm-1730~675cm-1返回取代苯返回邻二甲苯的红外光谱取代苯返回间二甲苯的红外光谱取代苯返回对二甲苯的红外光谱(5)醇游离羟基3650~3590缔合羟基3520~3100C-O伯醇1050cm-1仲醇1100~1125叔醇1150~1200返回乙醇的红外光谱(1%CCl4溶液)返回乙醇的红外光谱(液膜法)返回四乙基酚的红外光谱3500-3200C-O伸缩振动,由于p-π共轭键增强,吸收向高频移动1230(6)酚返回(7)醛和酮2-戊酮的红外光谱1715脂肪酮返回脂肪醛返回乙醛的红外光谱-CHOC=O芳香醛C=O伸缩振动苯甲醛的红外光谱图返回苯乙酮的红外光谱芳香酮返回酰基化合物的羰基伸缩振动频率cm-1OROHCOOHCCCOOHC1725~17001690~17151680~1700(8)羧酸及衍生物返回OROORCCOArOOArCCORClC1800~1850和1740~17901780~1830和1730~17701780~1850酰基化合物的羰基伸缩振动频率cm-1返回ORORCOROC-OArORCORNH2C1735~17501715~17301650~16901550~1630酰基化合物的羰基伸缩振动频率cm-1返回乙酸的红外光谱返回乙酸乙酯的红外光谱返回(9)胺N-H伯胺仲胺叔胺3500~3400cm-1有两个吸收峰有一个吸收峰无吸收峰C-N脂肪族胺伯芳胺仲芳胺叔芳胺1220~1020cm-11340~1250cm-11360~1280cm-11360~1310cm-1返回苯胺的红外光谱返回17.3.5红外光谱在结构分析中的应用鉴定已知化合物的结构确定未知物的结构返回确定未知物的结构了解样品的来源,背景,经元素分析,测定分子量,推出分子式,计算不饱和度。不饱和度计算43111()2unnnn4、n3、n1——分别表示分子式中化合价为4、3、1的元素的原子个数C7H5NO2的不饱和度为117(15)62u返回先观察高波数(1350cm-1)范围基团特征吸收峰,指定的归属,检出官能团,估计分子类型。观察1000~650cm-1的面外弯折振动,确定烯烃和芳香环的取代类型。若在这一区域没有强吸收带,通常指示为非芳香结构。返回化合物A(C5H10O)可被铬酸氧化为化合物B(C5H8O)。A和B同溴的四氯化碳及稀的高锰酸钾水溶液均不反应。例:返回返回OHAOB返回例:根据红外光谱图推测分子式为C4H10O化合物结构。返回①②③④计算出其不饱和度为0①3350cm-1缔合羟基的伸缩振动;②饱和碳原子的C-H伸缩振动;③1380cm-1双峰为叔氢的弯曲振动;④一级醇的C-O伸缩振动CH3CHCH2OHCH3推测化合物结构为:返回返回(NuclearMagneticResonanceSpectroscopy)17.4核磁共振谱(NMR)17.4.1核磁共振谱简介17.4.2核磁共振谱的基本原理17.4.3化学位移17.4.4自旋耦合和自旋裂分17.4.5峰的面积17.4.6核磁共振氢谱的解析17.4.1核磁共振概论 1945年F.Bloch和E.M.Purcell为首的两个小组几乎同时发现了核磁共振现象。二人因此获得1952年诺贝尔物理奖。返回(1)核磁共振基本原理存在自旋运动的原子核,其自旋运动将产生磁矩。原子核的自旋运动与自旋量子数I有关 I=0 原子核没有自旋运动 I≠0 原子核有自旋运动I的大小取决于原子的质量数(A)和原子序数(Z)的奇偶性17.4.2核磁共振谱的基本原理返回常见原子核的Z、A、和IZAI偶数偶数0奇数奇数1/2,3/2,5/2…偶数奇数1/2,3/2,5/2…奇数偶数1,2,3…AZX126C168,O3216S11H157N199F136C178O21H147N返回I=1/2的原子核电荷均匀分布于原子核表面,这样的原子核不具有电四极矩,核磁共振的谱线窄,最宜于核磁共振检测。如:11H136C返回(2)核磁能级例:I=1/2时,相对于H0有二种自旋相反的取向,+1/2和-1/2。△E-1/2+1/2EH0返回(3)核磁共振扫频:把物质放在恒定强度的磁场中,逐渐改变辐射频率,当辐射频率恰好等能级差时,即可发生核磁共振。扫场:保持辐射频率不变,逐渐改变磁场强度,当磁场达到一定强度时,即可发生共振吸收。(这种方法在操作上较方便)返回质子磁矩的取向外加磁场无磁场时质子的磁矩磁场中质子的磁矩低能量高能量(4)核磁共振氢谱(1HNMR)返回核磁共振现象发生共振吸收返回17.4.3化学位移 核外电子的旋转运动产生一个与外加磁场方向相反的感应磁场。因此质子所感受到的磁场强度,并非就是外加磁场的强度。即电子对外加磁场有屏蔽作用。屏蔽作用的大小与质子周围电子云高低有关,电子云愈高,屏蔽作用愈大,该质子的信号就要在愈高的磁场强度下才能获得。有机分子中与不同基团相连接的氢原子的周围电子云不一样,因此它们的信号就分别在谱的不同位置上出现。质子信号上的这种差异做化学位移。H0H感应返回(1)相对化学位移化学环境不同的质子,因受不同程度的屏蔽作用,在谱中的不同位置上出现吸收峰,但这种位置上的差异是很小的,很难精确地测出化学位移的绝对数值。故通常是以四甲基硅烷(CH3)4Si(TMS)作为标准物质,以它的质子峰作为零点,其他化合物的质子峰的化学位移则相对于这个零点而言。返回相对化学位移的表示方法:0(ppm)6010TMS为四甲基硅烷的吸收峰频率TMS0为核磁共振仪的频率返回内标物:四甲基硅烷(TMS)分子式:(CH3)4Si优点:所有的氢都是等同的,只有一个NMR信号;甲基氢核的屏蔽程度高,一般化合物的信号都出现在TMS峰的左边;沸点低,易于从样品中除去;化学稳定性好,与样品分子不会发生缔合;与溶剂或样品的相互溶解性好。返回常见基团的化学位移(δ)值-CH30.9ROH5-CH21.3-COOH11-CH2.0-CH2Cl3.7=CH25.0-CH2Br3.5≡CH2.5-CH2I3.2ArH7-8-CHCl25.8-CHO9.7(RO)2CH25.3-OCH33.8Ar-CH32.3ArOH7-COCH`2.3返回(2)影响化学位移的因素取代基的诱导效应(电负性)CH3-FCH3-OCH3CH3-ClCH3-I(CH3)4Si取代基的电负性减小δ4.263.243.052.160CH3–OHCH3-CH2OHCH3-CH2-CH2OHδ3.391.182.590.931.533.49αβαγβα返回取代基的诱导效应(电负性)返回(2)影响化学位移的因素各向异性效应化合物δ(ppm)CH3CH2-H0.96CH2=CH-H5.84CH≡C-H2.87.26H由电负性大小不能很好解释返回苯环氢的化学位移返回动画苯环氢的化学位移外加磁场感应磁场在苯环平面四周与外磁场的方向相同,产生去屏蔽作用外加磁场返回苯环氢的磁各向异性效应质子处于去屏蔽区域,在低场共振,化学位移值较大,δ为7.3屏蔽区域屏蔽区域HHHHHH去屏蔽区域返回环电流效应的存在作为芳香性判断HaHbOHbHa¡§OHaHb¡§[16]-轮烯δHa=5.28ppmδHb=10.3ppm无芳香性呋喃δHa=7.30ppmδHb=6.25ppm有芳香性二氢呋喃δHa=6.30ppmδHb=4.903ppm无芳香性返回乙炔氢的磁各向异性效应返回动画乙炔氢的磁各向异性效应返回乙炔氢的磁各向异性效应返回乙炔氢的磁各向异性效应返回乙炔氢的磁各向异性效应CCHH屏蔽区域屏蔽区域外加磁场H0乙炔氢在屏蔽区内,故在高场出峰返回(2)影响化学位移的因素氢键:氢键的形成能大大改变-OH、-NH2、-COOH上氢核的化学位移。氢键的形成,使氢变得更加正性,Xδ--Hδ+···Yδ-(Y为电负性大的O、N、F)。结果是使氢受到去屏蔽作用,共振峰移向低场(δ值变大)。返回例:乙醇中羟基质子的δ:δ=5.28ppm(在纯乙醇中,生成分子间氢键)δ=3~5.0ppm(在5%~10%的CCl4溶液中,部分形成分子间氢键)δ=0.7ppm(在稀的CCl4溶液中,很难形成分子间氢键)返回17.4.4自旋耦合和自旋裂分 相距较近的两个自旋氢核Ha和Hb之间有相互作用,称为自旋耦合。Hb核自旋磁场的方向可以与外加磁场同向或反向。进动所引起的额外磁场使核Ha的能级发生裂分。由于自旋耦合核Ha的吸收峰在核磁共振谱图上裂分为强度相等的双重峰,称为自旋裂分。反过来核Ha对核Hb也会发生同样的作用。自旋耦合通常只在两个相邻碳上的质子之间发生。返回邻近氢核的耦合示意图CCHbCCHbH0无裂分裂分HbCCHaCCHaH0无裂分裂分HaJJ返回n+1规律 当一个氢核有n个相邻的全同氢核存在时,其核磁共振吸收峰裂分为n+1个,各峰相对强度之比等于二项式(a+b)n的展开式各项系数之比。n峰面积比 峰的总数0 1 111:122 1:2:1 33 1:3:3:1441:4:6:4:1551:5:10:10:5:16返回返回自旋裂分返回自旋裂分返回自旋裂分返回自旋裂分核磁共振谱中,各峰的峰面积现在可用电子积分仪来测量,并在谱图上自动以连续阶梯式积分曲线表示出来。积分曲线的总高度与化合物中的质子的总数相应。各种质子的积分曲线高度之比,即各个峰面积之比,也就是各种质子数之比。17.4.5峰面积返回峰面积返回17.4.6核磁共振氢谱的解析对全未知的有机化合物,应首选测定分子量、元素组成,得到分子式,计算不饱和度;检查整个核磁共振图谱的外形;看峰的位置,即对每个峰的化学位移值进行分析;看峰的高度,以确定图中各峰所对应的氢原子的数目,对氢原子进行分配;看峰的形状、数目及耦合裂分情况,以确定基团和基团之间的相互关系;根据对各峰组化学位移和耦合关系的分析,推出若干结构单元,最后组合为几个可能的结构式;对推出的可能结构式进行指认,以确定其正确性。返回例:已知化合物(A)和(B)为异构体,分子式为C5H10O,(A)能起碘仿反应,其红外光谱在1705cm-1处有一强吸收峰;(B)不能起碘仿反应,其红外光谱在1690cm-1处有一强吸收峰;(A)、(B)的核磁共振谱如图所示,推(A)、(B)的结构。返回返回A:返回B:OCH3CH(CH3)2CA:abcOCH3CH2CH2CH3CB:abab返回推出(A)、(B)的结构为:上页退出



















