








《点化学研究方法PPT课件(共102页)》是由用户上传到老师板报网,本为文库资料,大小为581.5 KB,总共有102页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 102页
- 581.5 KB
- VIP模板
- ppt
- 数字产品不支持退货
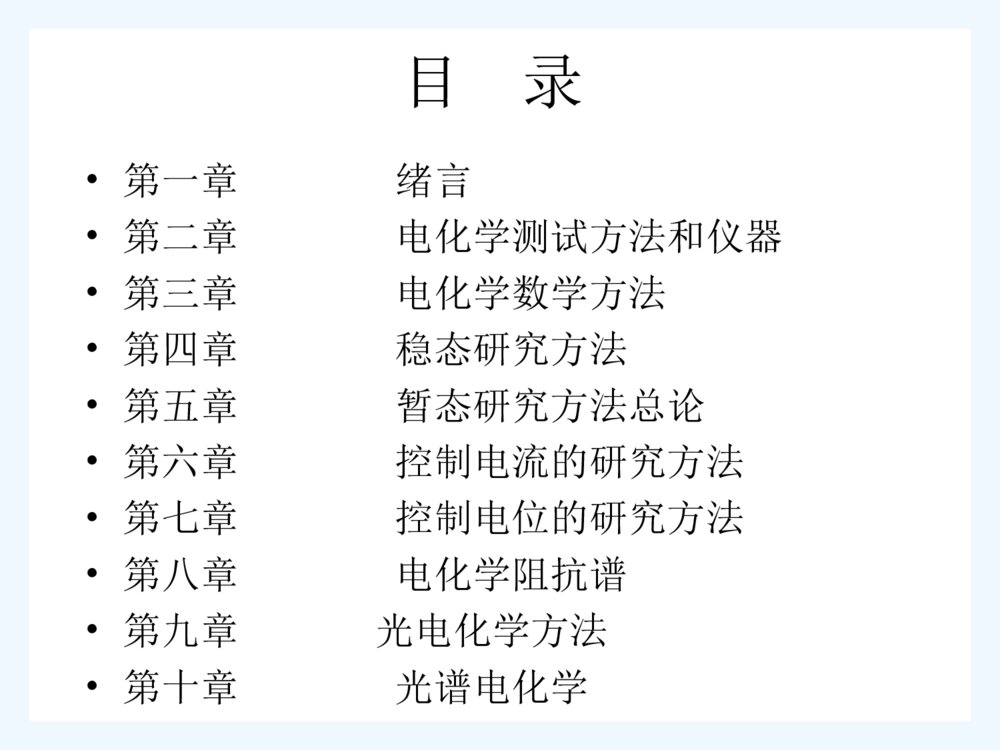
电化学研究方法ElectrochemicalMethods褚道葆教授讲授安徽师范大学化学与材料科学学院研究生课程教学目的:电化学研究方法广泛应用于生物与医学,能源与交通,航天航空、环境保护与治理,材料科学及绿色化学等各种高技术领域,本课程旨在使化学研究生熟悉和了解有机电化学研究方法的基本知识和实用技术,拓宽视野,增长技能,以适应日益快速发展的科学技术应用的需要。教学大纲:电化学研究方法主要由实验条件的控制,实验结果的测量和实验结果的解析三个部分组成,其内容包括常规电化学方法,最新技术进展,光学和谱学电化学研究方法。本课程以巴德的“电化学究方法:理论及应用”,田昭武院士的:“电化学研究方法”为参考教材”。共分十章,总课时60学时。目录•第一章绪言•第二章电化学测试方法和仪器•第三章电化学数学方法•第四章稳态研究方法•第五章暂态研究方法总论•第六章控制电流的研究方法•第七章控制电位的研究方法•第八章电化学阻抗谱•第九章光电化学方法•第十章光谱电化学第一章绪言1.1从电极过程存在的矛盾看电化学研究方法电极过程——电极总过程——基本过程①电化学反应(电荷传递反应)过程②反应物和产物的传质过程③电极界面双电层充放电过程④离子及电子的电迁移/电导过程⑤电极表面的吸、脱附过程⑥晶体生长过程⑦伴随的化学反应主要矛盾各种矛盾多步骤复杂抓主要矛盾:①反应物分子能量对活化能峰的矛盾影响因素:电极界面的电场、反应物活度、电极真实面积②浓差对扩散阻力的矛盾影响因素:电流密度及持续时间、反应物活度③电流对双电层电容的矛盾影响因素:电流密度及持续时间、表面活性物的吸附④溶液中的电场对电迁移阻力的矛盾影响因素:溶液中的电位差、电迁移距离、离子浓度等上述基本过程的地位随具体条件而变化,因此总过程的主要矛盾也会随之变化,具体情况要具体分析。基本原则:为了有效地研究某一基本过程,必须创造条件使该过程在电极总过程中占主导地位或主要地位,使该过程的主要矛盾成为电极总过程的主要矛盾,规定着总过程的发展,这是现代各种电化学研究方法所依据的基本原则。例如:测溶液的电阻或电导,必须使④过程占主导地位,使①②③过程退居次要地位。方法:电导池用铂黑电极,加速电化学反应速度,加大双电层电容,提高交流电频率。发展各种暂定方法:测量电化学反应速度:10-2~10cm.s-1分析灵敏度:10-5M~10-8M理论上必须深刻认识各种过程,方法上必须不断创新。1.2电化学研究方法的主要组成部分三个主要组成部分:①实验条件的控制②实验结果的测量③实验结果的解析①控制——设计电化学系统—三电极系统采用大面积铂墨对电极Luggin毛细管旋转圆盘电极深层电解池选择支持电解质改变反应物浓度控制极化电位(或电流)极化(测量)时间必须有执行控制的仪器和发出指令的仪器。②测量——电位和电流的则量测量仪器——函数记录仪、高度器、电位差计、数学电压表、联机计算机电化学测试:指根据电化学原理控制实验条件,并测量实验结果。必须采用现代电子技术和计算机③解析:电极过程的复杂性往往不能直接得到电极过程的参数,必须对测量的实验数据进行解析,才能计算得到电极过程的重要参数:热力学、动力学等参数方法——推导电极过程相应的数学方程采用方程的极限简化或解析方法配合适当的作图/或解方程如:η~logi;η~t1/2图得到直线或近似直线,再以截矩和斜度等计算某些参数。计算机模拟解析:数字模拟、等效电路模拟•计算机最优化曲线拟合:•建立方程组采用拟合方法求出最佳的待•定电化学参数。结合化学热力学、动力学、结构化学等知识深入研究电极历程。配合非电化学实验技术:表面技术、光谱技术等、X线、电子能、显微技术、示踪原子等。1.3电化学体系的基本性质及电极过程常用的基本关系式研究体系:有机电化学体系研究目标:主要研究有机分子或催化媒质在“电极/溶液”界面上电荷相互传递、电能和化学能相互转化以及旧键断裂、新键形成的规律.热力学、动力学、反应步骤及机理有机单电极过程:七个主要步骤串联而成.有机电极过程的“最慢步骤”---“控制步骤”1)有机电化学体系有机电池:通过有机电极反应产生电流供外线路负载使用的有机电化学体系电动势E:电池两端电位差W=QE=nFE=-ΔGE=-ΔG/nFF=96484.6C/mol=26.8Ah有机电解池:把电能转化为化学能,生成新的有机物质的有机电化学体系理论分解电压实际分解电压测定:电流-电压(I-V)曲线ABVaVanFRTEE反产ln0IREEca可逆分解2)极化作用极化:当有电流流过电极时,电极电位偏离平衡电位的现象称为电极的极化。过电位或超电势(overpotential):在某一电流密度下电极电位偏离平衡电位的差值的绝对值称为过电位。极化:浓差极化欧姆极化电化学极化电化学极化电化学反应引起的极化称电化学极化电化学过电位或活化过电位1905年Tafel公式:析氢反应jbaln0jwj浓差极化:scCCnFRTlnCCnFRTsaln过电位的测定电流-电位(і–Ε)曲线-----极化曲线曲线电解池:电池:jcaEE可caEE可影响过电位的因素:电极材料电极表面状态电流密度、温度电解液性质、浓度、杂质3)“电极/溶液”界面的基本性质4)5)界面对动力学影响因素:(1)电极材料的化学性质与表面状态(2)电极/溶液界面上的电场强度自然界存在的普遍现象:界面双电层研究电极/溶液界面结构与性质的意义:界面双电层的形成形成机理:a.界面两侧之间的电荷转移电子或离子等荷电粒子在两相中具有不同的化学位所致M1/M2电子导体/电子导体S1/S2离子导体/离子导体M/S电子导体/离子导体b.离子特性吸附形成分布于溶液一侧的荷电层 c.偶极子的定向排列水偶极分子电极/溶液界面的结构模型——双电层模型双电层结构:分散层GCS模型(Gouy-Chapman-Storn)紧密层内层模型双电层的溶液一侧由“若干层”组成:紧密层compactlayer厚度几个10-10M分散层diffuselayer厚度10-10—10-6MIHP——特性吸附,溶剂分子x1OHP——溶剂化离子x2DL——x2~溶液本体界面电位差:分散层电位对动力学是有重要意义。反应粒子在反应前所具有的能量。)()(11solMsolMa14)电极反应的基本关系式(1)电极过程的主要特征及研究方法①电极反应是特殊的多相化学反应伴有电极/溶液界面上电荷传递步骤的多相化学过程电极作用——电子导体和催化剂的双重作用特殊性——电极表面存在可以在一定范围内连续改变表面电场的强度和方向,从而改变电极反应的活化能和反应速度。电极过程动力学规律的特殊性:a)影响异相催化反应速度的一规律传质过程动力学:温度、压力、介质表面性质对反应速度的影响:真实表面积、活性中心、表面吸附、表面化合物的形成等等新相生成的动力学等等b)表面电场对电极反应速度的影响:电位改变1V~反应速度1010倍,通过改变电位控制电极反应速度——特点和优点。电极反应由多个单元步骤组成:七个步骤 “最慢步骤”控制电极反应速度(瓶颈效应)如“传质步骤”或“扩散步骤”“最慢”则电极速度服从“扩散动力学规律”。如“电荷转移步骤”“最慢”则整个电极速度服从“电子转移动力学”规律。电极过程动力学的主要目的就在于:识别“最慢步骤”并找到影响这一步骤速度的方法,从而达到控制反应速度的目的。②主要研究方法和技术Z(c,,j……)=f(t)体系参数与时间有关具体讲:a)流体动力学方法b)极化曲线测量技术c)电位扫描技术和循环伏安法(CV法)d)恒电流法、恒电位法e)阶跃暂态技术:阶跃电位法、阶跃电流法f)交流电技术、交流阻抗法g)谱学电化学方法:原位红外光谱法insituFTIR原位拉曼光谱法insituRM(2)电极反应速度通常用电流密度表示,根据Faraday定律得到:i=nFυυ-mol/s.cm2按照1UPAC惯例阳极电流ia—氧化反应速度取正号阴极电流ic—还原反应速度取负号电流符号同电极电位的变化趋势一致。Faraday电流——由Faraday过程引起的电流if--电荷传递反应引起某物质的氧化或还原,服从Faraday定律。非Faraday电流——没有电荷越过电极界面的非Faraday过程引起的电流ich:充电电流或电容性电流.不发生电化学反应,但有吸、脱附、界面结构变化.两个过程可能同时存在:i=if+ich电极反应速度方程O+ne=R根据法拉第定律:i=nFυ质量作用定律:阿累尼乌斯公式:k=Aexp()RCkvCokv�RTEaSOCknFi)exp(RTnFkko))1(exp(RTnFkkCknFiOSR�α——传递系数:0~1之间i=-==nFi=f(φ)i=0:==ioio–交换电流密度SRSOCknFCknFRTnFCkRTnFCkoSROSO)1(exp)exp(ii�ii�交换电流密度io和标准反应速常数又①bsCC平平平RTnFCknFRTnFCknFiiibRoboOo)1(exp)exp(�bRbooCCnFRTln平)exp()()()exp(obRboRTnFCCRTnF平∴②令③kS—标准速率常数④可由极化曲线测定得到。----表征电极催化活性的大小。其值越大,电极的催化活性越高为基本的电化学动力学参数。)exp()()(1OobRbooRTnFkCCnFi)exp(OOSRTnFkk)()(1bRboSoCCnFki,oiSoki,,,soki电流~过电位关系方程i~η关系,i=f(η)Butler-Volmer巴特勒—沃尔墨方程i=f(φ):i=nF复杂,不能实用RTnFCkRTnFCkoSROSO)1(exp)exp(∵=平)exp(RTnFCknFiSOo)exp()exp(RTnFRTnFCknFSOO平RTnFRTnFCknFiSRo)1(exp))1(exp平�-又)exp()exp(RTnFRTnFCknFSOO平iii�∴RTnFRTnFCknFSRo)1(exp))1(exp平)exp()()()exp(obRboRTnFCCRTnF平)()(1bRboSoCCnFki∴⑤假定i很小,溶液得到充分搅拌,电极表面上的物质浓度与溶液本体的浓度相近,即:则⑤式简化为⑥这就是著名的Butler-Volmer(巴特勒—沃尔墨)方程表明电荷转移步骤控制时电流和过电位之间的关系RTnFCCRTnFCCiiiibRSRboSOo)1(exp)exp(�RTnFRTnFiio)1(exp)exp(电化学控制时,极化曲线的显著特点:不出现极限电流平衡时:由∴⑦由动力学方程推出Nernst方程平平RTnFCknFRTnFCknFbRobOo)1(exp)exp(bRboOOCCnFRTkknFRTlnln平bRbooCCnFRTln电化学极化a.阴极极化b.≫B-V公式中的第二项可忽略不计,则⑨lnic=lnio+∴⑩ii�)exp(cocRTnFiicRTnFcocinFRTinFRTlnln由动力学推出Tafel公式:=a+blni可得到a、b的物理意义截矩斜率 ,25℃:~lnln0iinFRTanFRTb5.0mVnb59b.阳极极化:则(11) c.决定电化学极化数值的主要因素是净电流与交换电流密度的相对大小。即:i/io的大小aainFRTinFRTlnln0分别讨论二种极端情况1) «由⑨式及:(12)∵«∴→0近乎可逆状态AocciinFRTlnoaaiinFRTln)1(ii0i0i由B—V⑥式一级数开得:(13)正比线性关系令电荷传递电阻则:=Rri类似欧姆定律3121132xxxexRTnFiRTnFRTnFii00))1((inFiRT0iornFiRTR1.4界面层结构的研究方法1)电极体系的等效电路Ti/nano-TiO2电极在1mol/LH2SO4溶液中未发生膜反应时的等效电路 if—电化学反应电流或法拉弟电流ic—双电层充电电流或电容电流i=ic+if若if=0i=ic理想极化电极ic=0i=if理想不极化电极2)界面性质的参数①界面张力:作~关系曲线②微分电容③电极表面剩余电荷密度:q~曲线3)电毛细曲线法将理想极化电极极化至不同电位并同时测量界面张力得到的曲线为电毛细曲线。曲线的最高点对应的电极电位称为零电荷电位,其表面剩余电荷密度为零 a.~曲线b.q~曲线零电荷电位(p.z.c)具有更为普遍的意义,在电化学科学中有可能把确立为基本的参考电位。参照的电极电位称为“合理电位”或“零标”:00VCuVSnVPbVHg09.0,42.056.0,19.04)微分电容法平板电容器电容界面双电层电容测量方法:交流电桥法、载波扫描法交流阻抗法、方波法Cd反映了电极/溶液界面的结构及变化情况。包括:表面状态、真实表面积吸附及表面膜的生成剩余电荷、零电荷电位等20/,cmFlCr22ddqCd5)电极/溶液界面的吸附现象表面活性粒子的“特性吸附”:①不参加电极反应,吸附后改变电极表面状态及界面层的电位分布,从而影响反应粒子的表面浓度及电极反应活化能。②反应物或产物吸附则直接影响有关分步骤的动力学参数。a)无机离子吸附离子吸附规则S2->I->Br->Cl->OH->SO42->F-b)有机分子吸附“憎水基团”、“亲水基团” 广泛应用微分电容法研究:Cd显著降低,可计算表面吸附覆盖度,吸附量。第二章电化学测试方法和仪器 2.1概述——电化学测试方法的优点①直接现场研究②一般比较快,短时间内可得到结果③仪器设备相对较便宜非电化学方法近来发展迅速,但需要电化学方法配合——电化学测试的主要任务在电化学研究的原理指导下控制实验条件,并测量在此控制条件下实验的结果。△实验条件的控制根据实验要求控制电解池系统极化的电位、电流(或电量)极化的程度:小幅度、大幅度极化的方式:恒定、阶跃、方波、扫描、交流、载波等。极化的时间:稳态、暂态必须有执行控制的仪器和发生各种指令的仪器。△实验结果的测量一般对象是电极的电位、电流、阻抗以及它们随时间的变化,有时要测电量、电流对数表面电场界面双电层——电化学测试技术△根据对某一特定方法的需要,将定型的商品仪器组合起来进行测试如:信号发生器+恒电位仪测极化曲线正弦波发生器+恒电位仪测交流阻抗△按电化学的特殊要求设计专用仪器将各种方法(控电位、控电流、稳态/暂态、电极交流阻抗等)的测量综合起来,利用多种电化学研究方法,从各方面对电化学体系进行综合性研究——电化学工作站△测试系统都是由 ——如何得到正确的测量结果△理解电化学测试基本原理△了解电化学测试对仪器的要求——范围、精度△认识仪器的性能△熟悉仪器的正确使用方法新仪器发展很快,推动电化学研究方法的发展。三部分组成解析单元控制单元指令单元2.2控制部分1.电位控制恒电位仪——控制电极电位→恒电位极化——控制电极电流→恒电流极化——配以指令信号(方波、三角波、正弦波等)可以研究电化学系统的各种暂态行为——配以控制扫描信号,可自动进行拟稳态极化曲线测量仪器原理利用运算放大器经过运算使得参比电极与研究电极之间的电位差严格地等于输入的指令信号电压 恒电位仪原理图2.恒电位仪基本性能和设计要求(1)控制精确度:电位:1mV±4V输入电压:>10V电流:A级要求:漂移小,噪音低,开环放大倍数高,采用集成运算放大器。(2)输出功率:用集成功率放大器,提出大的输出电流,较高的输出电压。(3)输入阻抗:参比电极可以允许流过多少电流:要求:电流<10-7A(0.1μA)采用场效应管输入级集成运算放大器<100pA(10-10A)利用反馈进行补偿,可使放大器输入电流的输入50nA采用集成静电计放大器:<0.01pA(4)Ohm电位降补偿产生于电解率包括隔膜的Ohm电阻采用Luggin毛细管使参比电极尽量靠近研究电极,减少误差精确测定中,利用电子技术加以补偿(5)动态特性:控制的精确度,响应速度及稳定性暂态实验:要求微妙或亚微妙级的响应时间,即良好的高频特性,“完美”的恒电位仪,如使用不当,也会得出错误的结果。(6)对电解池系统的要求辅助电极和研究电极(WE)之间的电阻低研究电极面积小,极间杂散电容小研究电极上的电流密度分布均匀尽可能减少参比电极内阻,减少参比电极对地的分布电容(7)其它方面二电极电化学系统,可接成控制槽电压系统,控电位为零,则测得短路电流,将电池串联负载电阻RL,并控制电位为零,则可实现电池的恒负载放电。3.电流控制一般恒电位控制与恒电流控制可设计为一个系统,通过开关转换。4.控制电位脉冲电流法5.其它控制方式 2.3指令部分指令信号指多程波(方波、三角波、正弦波)单程波(扫描、阶跃等)组合波(波形叠加)快波形与慢波形发生器1慢波形发生器利用Miiller积分电路获得线性扫描电压信号 快波形发生器:用于暂态实验,方波、三角波、正弦波。函数发生器:现成商品,可直接使用于电化学测试中。2.4解析部分在恒电位或恒电流控制下,电极按指令信号的变化规律极化,极化结果的响应信号必须给以观察测量和记录,进而进行解析获得有关参数。如:将电极电流的变化进行对数变换以求得Tafel斜率或进行积分以求得通过电极的电量。从电极总阻抗中分离出实数部分和虚数部分以求得电极交流阻抗等。即可根据电化学研究方法的特殊要求而设计专用仪器,也可利用各种现成的仪器。电化学测试中解析部分所包括的内容,随电化学研究方法的发展以及现代电子测量仪器的发展而发展。2.5微机与恒电位仪联用技术微型电子计算机在电化学领域中应用非常广泛,微机联用电化学测试系统比常规电化学测试系统在使用灵活性、性能指标、功能指标方面都有重大进展,引起极大重视。微机包括中央处理器(CPU)——主板硬件、软件打印机显示器键盘外设光驱、软驱等硬盘存贮器电脑),(ROMRAM通过计算机总线联系在一起,由系统软件和应用软件指挥硬件工作,达到计算、控制和操作的目的。微机内部设有扩展槽供用户连接外部设备。电化学恒电位仪通过插在扩展槽中的接口板与微机总线连接,用程序对恒电位仪进行操作,达到联用目的。联用关键是选用合适的接口板和改装恒电位仪,统称联用接口技术。CHI660A电化学工作站(上海、美国)LK电化学工作站(天津、中国科大)第三章电化学数学方法3.1电化学体系的数学描述各种物理量(φ、i、c等)以及它们对时间t或坐标x的导数常微分方程(组)或偏微分方程(组)这些微分方程按照化学和电化学反应动力学扩散,对流及电迁移等的客观规律而建立起来,并按照实验体系的条件而给定初始条件、边界条件。数学描述反应过程电化学过程是多相化学电极是多相体系大部分采用数值解变换解析解解方程Laplace如:Fick第二扩散定律为下列偏微分方程①其物理意义为,在某位置的浓度增加率等于在该位置的扩散速度场的散度。D为扩散系数,与时间无关。在分析电极所发生的基本过程和确定电化学研究方法基础上,相应建立曲线拟合——比较)(2222222zcycxcDcDtc理论曲线实验曲线电化学测量体系解函数电化学数学模型x3.2实验曲线拟合的最优化方法系统的性质可用参数表示,如:R,ic简单情况:可用“极限简化”法直接得到复杂情况:存在多个同时未知的待定参数,一种简便方法是把“解函数”整理成一次或二次标准曲线方程,如:Tafel方程η~lgi,Cottrell方程,iα~t关系等;“解函数”表达式相当复杂,无法整理成“一次或二次曲线方程”,甚至不能给出解析解,只能应用“电化学数值解”一组相关数字的“表格函数”,如何与实验曲线比较?“曲线拟合法”——用代数多项式或其他关系式近似表述实验曲线的方法。若一已知“解函数”(或理论曲线方程)y=f(x,B)②x,y为实验测量值B是含有n个电化学参量的列向量,即B=(b1,b2,…bn)③另,已知实验曲线的m对实验点,即(xk,yk),k=1,2,…m,且m》n④曲线拟合就是在上述已知条件下,寻求某种方法确定B值,代入②式,使计算的理论曲线解最佳通过实验点曲线拟合最优化示意图——理论曲线最佳通过实验点的标准——按“最小二乘法”规定的“目标函数值Q(B)”达到最小值,即:⑤mkkkBxfyBQ12)],([)(第四章稳态的研究方法4.1稳态的意义什么是稳态?在指定的时间范围内,电化学体系的参数(如电位、电流、浓度分布、电极表面状态等)变化甚微,基本上可认为不变,这种状态可以称为电化学稳态。如电池放电、金属腐蚀、电镀、电解过程、“中期”稳定过程。稳定不等于平衡态,平衡态是稳定的特例。如Zn/Zn++电极:阳极溶解稳态时:>阳极氧化电流是一个稳定值:ia=-电极界面Zn++浓度不变,电极电位也不变,相对稳态,绝对稳态是不存在的。zeZZnn2:平ii�zeZZnn2iiii未达到稳态的那个阶段则称为暂态;稳态和暂态是相对而言的,从暂态到稳态是逐渐过过渡的;划分是以参量变化显著与否为标准,与所采用的仪表的灵敏度和观察时间有关;只要根据实验条件在一定时间内的变化不超过一定值的状态,就可称稳态;一般讲,当电极电位和电流同时稳定不变(实际是变化速度不超过一定值)时就可以认为已达到稳态,按稳态系统来处理。4.2稳态系统的特点稳态系统的条件:电流、电极电位、电极表面状态、电极界面区浓度等,均基本不变。(1)电极双电层的充电状态不变,双电层电荷不变,等效电路中可忽略双电层电容(2)电极界面的吸附覆盖状态不变,吸脱附电流为零,等效电路中的吸附电容可忽略。(3)稳态电流全部为电极反应所产生的,如有多对电极反应,则为总结果。(4)扩散层分布:在电极界面附近存在参加电极反应物质浓度变化的液层,称之为扩散层自然对流下:厚度5×10-2cm强迫对流下:减小几倍~几百倍静止扩散浓度分布符合扩散规律:Fick第一定律:(5)扩散流量:mol/cm2,扩散系数浓度梯度Fick第二定律:(6)为Laplace算符dxdcDdtdNcDtc22对平面电极:(7)稳定时:常数,由Fick-l求得∴(8)(9)l为扩散层厚度,CS为表面浓度,Cb为内部浓度22xcDtcdxdctc,00)()(xoxdxdcnFDdtdNnFdtdQilCCnFDxcnFDisb对流作用存在时(忽略电迁移)扩散层没有明显的界线 则(10)当cs→0时,i达极限,称稳定极限电流(11)0)/(xsbdxdcCCdibdnFDCi代入(10)得:(12)(9)、(12)适用于电极反应的反应物,对于产物应改为:(13)(14))1(dbsiiccbsccnFDi)1(dbsiicc4.3各种类型的极化和过电位电极过程的控制步骤主要决定了电极过程的动力学特征,相应的极化类型也依此而决定。极化类型有许多种:①电化学极化=电荷传递极化=活化极化②浓差极化:由传质过程控制引起的极化③Ohm的极化=电阻极化④均相或多相化学反应极化⑤电结晶极化•主要讨论①阳极极化过电位②浓差极化过电位③Ohm极化过电位假定电化学反应为简单的电荷传递反应⇌R(15)稳定时,无浓差极化:(16)Butler-Volmer(巴特勒—沃尔墨)方程≡称为阴极极化过电位acRneORTnFRTnFiio)1(exp)exp(e假定i很小,溶液得到充分搅拌,电极表面上的物质浓度与溶液本体的浓度相近,即:表明电荷转移步骤控制时电流和过电位之间的关系。考虑浓差极化时,应乘上校正因子:(17)(18)(18)式为同时存在电化学极化和浓差极化时的i=f(η),既适用于不可逆电极,也适用于可逆电极,对各种程度的极化:均适用。RTnFCCRTnFCCiiiibRSRboSOo)1(exp)exp(�1/,1/bRSRbOSOCCCCbRSRbOSOCCCC/,/RTnFRdRTnFOdoeiieiiii/)1(/))(1())(1(当CO=CR=C时:(19)比值决定了电极的可逆性。cnFkisolnFDcidDlkiisdo/doii/△当则整理后得:(20)过电位完全由浓差引起,表现为可逆电极,浓差总占主导地位,要从稳态极化曲线研究电化学极化或电化学反应速度是不可能的。一般情况下,l≈10-2~10-3cm;D≈10-5cm2S-1∴稳定极化曲线不宜于研究电化学反应iiiDk,iidosdo式中即时)18(1/0))(1())(1(/)1(/RTnFRdRTnFOdeiieiicOdRdiiiinnFRT))(1ln())(1(12.10scmks△当,表现为不可逆电极,在不同的过电位范围表现出不同的极化程度当时,逆反应可忽略,则由(18)式得(21)整理后得:(22)第一项为电化学极化过电位。第二项为浓差极化过电位。时1/doiinFRTRTnFeiiiiOdo))(1(iiinFRTiinFRTododo)()(lnln(23)(24)若i«(id)o≈0,则=在logi~图上可以得到Tafel直线 不可逆电极的极化曲线和具有完全不同的特征oaiinFRTlniiinFRTododc)()(lncaca小电流时,以为主,随电流变化的规律不同大电流时,以为主,随电流变化的规律不同由(22)式可知:作图得直线,由直线斜率和截矩分别可以算得cEiiiiodod)()(log~oin和nFRT,平附近(18)式中的指数项可展开为级数,保留前两项,略去各项,整理得:(25)~i曲线为直线性,可逆对极,当决定于后两项稳态浓差极化电阻不可逆电极,可略去后两项,则有(26)利用(25)、(26)式可以稳态极化曲线在附近的斜率计算交换电流密度.i))(1)(11(RdOdOiiinFRTiRi为极化电阻R,iiiRdOdo时)(,)(RnFRTinFRTio1e△欧姆极化:电子导体(金属)离子导体(电解质溶液)都有电阻产生ohm电位降,称为ohm极化过电位,符合欧姆定律:(27)R1,可从溶液的比电阻及液层的截面和厚度计算得到,考虑到则(28)(29)实际情况位于更复杂:如平行电极反应,多步电化学反应,等宜采用暂态技术或流体动力学技术。iRRRRca1))(1)(11(RiiinFRTiRdOdo4.4各种极化的特点与影响因素△电化学极化是由电化学反应速度决定的,与电化学反应本质有关:①化学反应活化能:各种反应活化能相差悬殊,因此反应速度的差别是以数量级计即相差几个数量级。②温度对反应速度的影响较大:提高温度、提高催化剂活性,增大电极实际表面积等都能提高电化学反应速度而降低电化学极化,表面活性物质在电极界面的吸附或成相覆盖层(如钝化膜)的出现可能大幅降低电化学反应速度。③界面电场也影响电化学反应速度:电位1,oEiinFRTln△浓差极化是扩散速度决定的:气相扩散——D≈10-1cmS-1液相扩散——D≈10-5cmS-1扩散途径即扩散层厚度能大幅度改变扩散速度,强制对流比自然对流扩散层厚度低1~2个数量级。两个特点:①达到稳态的时间较长,几秒~几百秒②当i接近时增长很快极化曲线上表现为电流平阶di)log(3.2iiinFRTddcc△Ohm极化由溶液电阻决定,与溶液电阻率有关,高电阻率系统(如高纯水),电阻极化可达几~几十V溶液电阻又与电极间距有关,与隔膜的厚度、层数、孔率、孔的曲折系数有关,这些都与电解池或电池的结构密切相关。两个特点:①与R成正比:②当i变化瞬间时,紧跟着变化,常用方波电流法单独测量RR4.5流体动力学的稳态研究方法前面分析均忽略对流传质的影响,而传质行为在电极过程中相当重要,只限于宏观处理:常用研究技术:①旋转园盘电极(RDE)②旋转环盘电极(RRDE)旋转园盘电极技术:可在强迫对流下,测量不同转速的稳态极化曲线在溶液相中,同时存在扩散传质、对流传质过程在稳态条件下,稳态流量:对流扩散层的等效厚度:25℃为动力粘度,cm2/S,流体粘度/密度2/31/61/20()0.62()bsiiiyiicDDccy1/31/61/21.61lD极化曲线中极限电流id与关系有:A为电极面积,Cb为本体浓度可求D,或Cb等,优点:易于建立稳态,重现性好,可通过转速控制溶液相传质过程l2/16/13/262.0/DnFAClnFADCibbd2/1di4.6简单电极反应动力学参数测量对于⇌R反应在RDE的电流i为:同时有:RTnFbRSRRTnFbosooeCCeCCii/)1(/)1()(bosoodsoboCCilCCnFADoi)1()(bRSRRdCCiineO式中联立上式消去、则有:式中无浓差极化电流2/16/13/262.0)(ObRodDnFACi2/16/13/262.0)(ObRRdDnFACiSRCSOC)(11niia)(/)1(/RTnFRTnFoaeeii电位函数作图为直线,可求RTnFRTnFRbRbOeeDCDCnFA//3/213/216/11)()(61.1)(2/1~1i、oi△如⇌电极反应的动力学参量作i~η曲线作直线,求扩散系数DeCNFe36)(46)(CNFe2/1diScmDCNFe/104.526)(36ScmDCNFe/107.66)(46作~直线可求,再求由得到i1215.0,oiai22/102.1cmAio)()()1(bRbOsoCCnFkiscmks/102.124.7多孔电极的稳态极化特点应用特有困难有利于物质传输有合适的传输通道有利电化学反应高真实表面积电解合成电分析环保燃料电池化学电源—理论方程复杂物理模型不成熟气三相界面液固同时发生反应交错传输多种传输过程复杂,,——△“不平整液膜”模型①催化层的结构和不平整液膜“气体通道”~“液体通道”交错而成“多孔导电团粒”——粗糙表面,大部分被溶液淹没,厚薄不同液膜②传输过程机理——八个基本过程3.旋转园盘电极(RDE)RDE(RotatingDiscEletrode)测定体系电化学参数的重要实验方法之一.可测扩散过程电化学反应动力学参数.广泛用于电极过程动力学研究.RDE极限扩散电流公式根据流体动力学理论可导出扩散层原度①δ——扩散层厚度cmD——扩散系数,cm2·s-1——溶液的运动粘度St.cm2·s-1,——旋转角速度,25℃①式简化:2/12/13/136.0)(316.0893.0805.1DvD2/16/13/161.1D扩散控制时:则成正比。)(62.02/16/13/2SbCCnFDibdCnFDi2/16/13/262.0bdCBi2/12/13/2,,bdCDi当n、D、ν、Cb为定时,可求n、Cb、D、νRDE应用测扩散系数D测不同转速下的极化曲线,可得不同id值作bdCnFD。,i6/12/1620~斜率为应为直线~i图2/1~di通常取则由斜率可求D:6.77×10-6cm2·s-16.84×10-6cm2·s-16.65×10-6cm2·s-1关系上的在2/136~)(diRDECNFe12210scm测动力学参数:i0、ks、α测反应电子数:n测电化反应级数:判断控制步骤。反应级数zckizsc,)(



















