








《《离子反应》高中化学优质PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为1.69 MB,总共有49页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 49页
- 1.69 MB
- VIP模板
- ppt
- 数字产品不支持退货
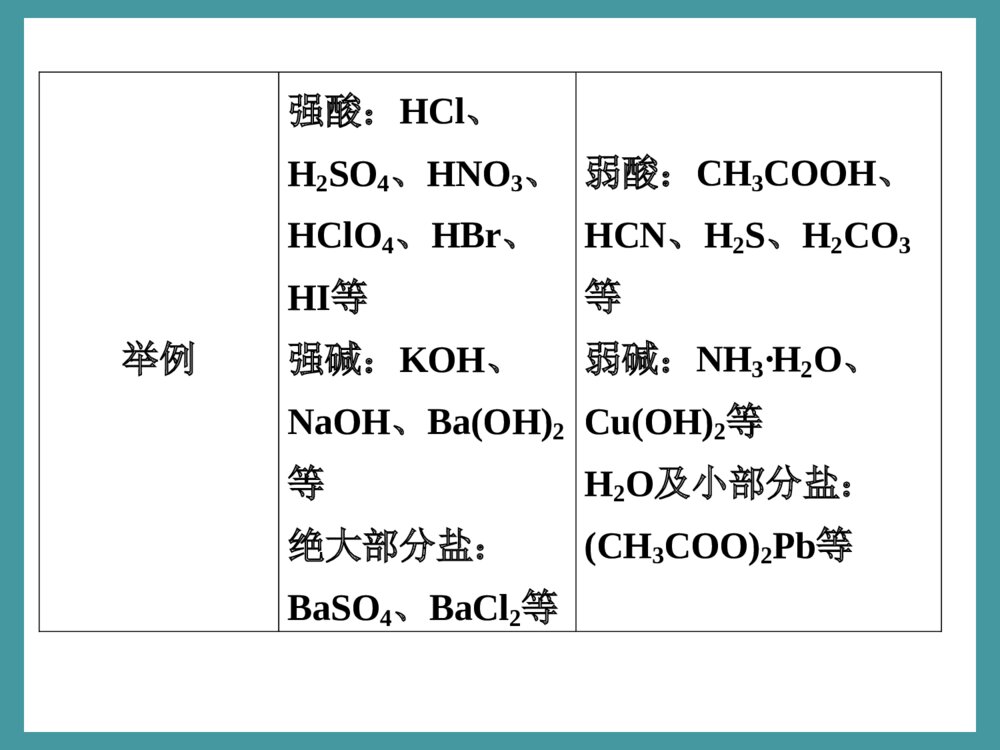
第2讲离子反应和离子方程式[考纲解读]1.能正确辨析电解质、强电解质和弱电解质的概念。2.了解电解质在水溶液中的电离以及电解质溶液的导电性。3.能正确书写离子方程式,并判断其正误。·基础再现深度思考考点一电解质1.电解质和非电解质(1)电解质在能够导电的叫做电解质。(2)非电解质在都不能导电的叫做非电解质。水溶液里或熔融状态下化合物水溶液里和熔融状态下化合物2.强电解质和弱电解质的比较强电解质弱电解质定义在水溶液中能电离的电解质在水溶液中只能电离的电解质电离平衡溶液中存在微粒种类水合离子、水合离子、、电离过程完全部分不存在存在水分子水分子弱电解质分子不可逆、不存在电离平衡可逆、存在电离平衡举例强酸:HCl、H2SO4、HNO3、HClO4、HBr、HI等强碱:KOH、NaOH、Ba(OH)2等绝大部分盐:BaSO4、BaCl2等弱酸:CH3COOH、HCN、H2S、H2CO3等弱碱:NH3·H2O、Cu(OH)2等H2O及小部分盐:(CH3COO)2Pb等3.电离方程式的书写(1)强电解质:完全电离,用表示。如H2SO4、NaOH、(NH4)2SO4的电离方程式分别为:、、。(2)弱电解质:部分电离,用表示。①多元弱酸分步电离,且电离程度逐步减弱,酸性主要由第一步电离决定。如H2S电离方程式为,。==H2SO4===2H++SO2-4NaOH==Na++OH-(NH4)2SO4===2NH+4+SO2-4②多元弱碱分步电离,但一步写出。如Cu(OH)2Cu2++2OH-。③两性氢氧化物双向电离。如Al(OH)3的电离方程式:(3)酸式盐①强酸酸式盐完全电离,一步到底。如NaHSO4在水溶液中的电离方程式为,在熔融状态下的电离方程式为。②多元弱酸酸式盐,第一步完全电离,其余部分电离。如:NaHCO3=Na++HCO-3;HCO-3H++CO2-3NaHSO4===Na++H++SO2-4NaHSO4===Na++HSO-4深度思考1.下列物质中,属于电解质的是________,属于非电解质的是________;属于强电解质的是________,属于弱电解质的是________;并写出电解质在水溶液中的电离方程式:_________________________________________。①H2SO4②HCl③氯气④硫酸钡⑤酒精⑥铜⑦醋酸⑧氯化氢⑨蔗糖⑩氨气⑪CO2⑫NaHCO3①②④⑦⑧⑫⑤⑨⑩⑪①②④⑧⑫⑦基础再现·深度思考2.下列说法中一定正确的是()A.强电解质溶液的导电性比弱电解质溶液的导电性强B.BaSO4投入水中,导电性较弱,故它是弱电解质C.弱电解质溶液中存在两种共价化合物分子D.氯水能导电,所以Cl2是电解质C基础再现·深度思考3.在如图所示电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一种溶液时,则灯光由亮变暗至熄灭后又逐渐变亮的是()A.盐酸中逐滴加入食盐溶液B.醋酸中逐滴加入氢氧化钠溶液C.饱和石灰水中不断通入CO2D.醋酸中逐滴加入氨水C考点二离子反应和离子方程式1.离子反应(1)概念:有或有的反应统称为离子反应。(2)离子反应的条件在稀H2SO4中分别加入下列物质,能发生反应的请写出有关的离子方程式:A.加入BaCl2溶液:,B.加入CH3COONa溶液:,C.加入Na2CO3溶液:,D.加入Zn粒:,离子参加离子生成Ba2++SO2-4===BaSO4↓CH3COO-+H+===CH3COOHCO2-3+2H+===CO2↑+H2OZn+2H+===H2↑+Zn2+E.加入NaOH溶液:。从A~E可知离子反应发生的条件:①生成难溶的物质;②生成的物质;③生成的物质;④发生。(3)离子反应的本质A~E中,混合后溶液中SO2-4的物质的量减少的是(填序号,下同);H+物质的量减少的是;因此离子反应的本质是溶液中某些离子的物质的量的。难电离易挥发氧化还原反应AB、C、D、E减少H++OH-===H2O2.离子方程式(1)概念:用来表示反应的式子。(2)意义:离子方程式不仅可以,还可以表示。(3)离子方程式的书写:写、改、删、查实际参加反应的离子符号某一个具体的化学反应同一类型的离子反应深度思考4.写出下列典型反应的离子方程式:(1)氯化铝溶液中加入过量氨水(2)小苏打与乙酸溶液混合(3)氧化镁溶于稀硫酸(4)澄清石灰水中加入盐酸(5)Cl2通入水中Al3++3NH3·H2O===Al(OH)3↓+3NH+4HCO-3+CH3COOH===CH3COO-+CO2↑+H2OMgO+2H+===Mg2++H2OOH-+H+===H2OCl2+H2OH++Cl-+HClO(6)明矾溶于水发生水解(7)实验室用浓盐酸与MnO2共热制Cl2(8)在石灰乳中加入Na2CO3溶液(9)NH4Cl溶液与NaOH溶液混合(10)浓HNO3与Cu的反应Al3++3H2OAl(OH)3(胶体)+3H+4H++2Cl-+MnO2=====△Cl2↑+2H2O+Mn2+Ca(OH)2+CO2-3===CaCO3↓+2OH-NH+4+OH-===NH3·H2OCu+4H++2NO-3===Cu2++2NO2↑+2H2O(11)浓H2SO4与Cu混合加热(12)(NH4)2SO4溶液与NaOH溶液混合加热(13)Na2SO4溶液与AgNO3溶液混合(14)NaHCO3溶液与稀盐酸混合(15)NaHSO4溶液与NaOH溶液混合Cu+2H2SO4(浓)=====△CuSO4+SO2↑+2H2O。NH+4+OH-=====△NH3↑+H2O。SO2-4+2Ag+===Ag2SO4↓。HCO-3+H+===H2O+CO2↑。H++OH-===H2O。反思归纳(1)离子方程式的书写关键点书写离子方程式的关键是依据客观事实,抓住两易、三等、两查。两易:即易溶、易电离的物质(可溶性的强电解质包括强酸、强碱、大多数可溶性盐)以实际参加反应的离子符号表示,非电解质、弱电解质、难溶物、气体等用化学式表示。三等:即三个守恒,①必须遵循质量守恒原理(即反应前后原子种类及个数应相等);②必须遵循电荷守恒原理(即反应前后阴阳离子所带的电荷总数应相等);③必须遵循电子得失守恒原理(适用于氧化还原反应的离子方程式)。两查:检查各项是否都有公约数,写成最简的化学计量数,是否漏写必要的反应条件。(2)书写离子方程式的注意点①微溶物处理方式有三种情况a.出现在生成物中写化学式;b.做反应物处于溶液状态写离子符号;c.做反应物处于浊液或固态时写化学式。②盐类水解的离子方程式不要忘记“”。③溶液中铵盐与碱反应加热放出NH3↑,不加热写NH3·H2O。④浓HCl、浓HNO3在离子方程式中写离子符号,浓H2SO4不写离子符号。⑤HCO-3、HS-、HSO-3等弱酸的酸式酸根不能拆开写。·规律方法解题指导规律方法离子反应中的多重反应两种电解质溶液混合,至少电离出两种阴离子和两种阳离子,这四种(或更多种)之间都能两两结合成难电离(或难溶)的物质。这样的离子反应称为多重反应。在写这类反应的离子方程式时易丢其中的一组反应。规律方法·解题指导【例题】完成下列反应的离子方程式:(1)Ba(OH)2溶液与(NH4)2SO4溶液混合:____________。(2)CuSO4溶液与Ba(OH)2溶液混合:_______________。(3)NH4HCO3与过量NaOH溶液混合:______________。(4)Ba(OH)2与H2SO4两稀溶液混合:________________。(5)Fe2O3溶于HI溶液中:_________________________。(6)FeBr2溶液中通入过量Cl2:____________________。(7)FeO溶于稀HNO3中:_________________________。第2讲答案(1)Ba2++2OH-+2NH+4+SO2-4===BaSO4↓+2NH3·H2O(2)Cu2++SO2-4+Ba2++2OH-===BaSO4↓+Cu(OH)2↓(3)NH+4+HCO-3+2OH-===NH3·H2O+CO2-3+H2O(4)Ba2++2OH-+2H++SO2-4===BaSO4↓+2H2O(5)Fe2O3+6H++2I-===2Fe2++3H2O+I2(6)2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-(7)3FeO+10H++NO-3===3Fe3++NO↑+5H2O规律方法用分类思想突破跟量有关的离子方程式的书写中学化学中出现了许多跟用量有关的离子反应,且较简单的跟用量有关的离子反应方程式的书写、正误判断及其运用,又是中学化学中的重点和高考的热点,但同学们在对跟用量有关的离子反应进行识记、辨别、理解和运用时,均有较大难度。对跟用量有关的离子反应,若能按其成因进行归类疏理,就不仅可以知其然,而且还可以知其所以然了。1.连续型指反应生成的离子因又能跟剩余(过量)的反应物继续反应而跟用量有关。(1)可溶性多元弱酸(或其酸酐)与碱溶液反应。如CO2通入NaOH溶液中:①碱过量:②碱不足:(2)多元弱酸(或其酸酐)与更弱酸的盐溶液。如CO2通入NaAlO2溶液中:①NaAlO2过量:②NaAlO2不足:CO2+2OH-===CO2-3+H2O;CO2+OH-===HCO-3。2AlO-2+CO2+3H2O===2Al(OH)3↓+CO2-3;AlO-2+CO2+2H2O===Al(OH)3↓+HCO-3。(3)多元弱酸盐与强酸反应。如Na2CO3溶液与稀盐酸:盐酸不足:盐酸过量:(4)铝盐溶液与强碱溶液铝盐过量:强碱过量:(5)NaAlO2溶液与强酸溶液NaAlO2过量:强酸过量:CO2-3+H+===HCO-3;CO2-3+2H+===CO2↑+H2O。Al3++3OH-===Al(OH)3↓;Al3++4OH-===AlO-2+2H2O。AlO-2+H++H2O===Al(OH)3↓;AlO-2+4H+===Al3++2H2O。(6)FeCl3溶液与Na2S溶液FeCl3过量:Na2S过量:(7)Fe与HNO3溶液Fe过量:HNO3过量:2Fe3++S2-===2Fe2++S↓;2Fe3++3S2-===2FeS↓+S↓。3Fe+2NO-3+8H+===3Fe2++2NO↑+4H2O;Fe+NO-3+4H+===Fe3++NO↑+2H2O。2.先后型一种反应物的两种或两种以上的组成离子,都能跟另一种反应物的组成离子反应,但因反应次序不同而跟用量有关。又可称为竞争型。NH4HSO4溶液与NaOH溶液的反应:NaOH不足:NaOH过量:H++OH-===H2O;NH+4+H++2OH-===NH3·H2O+H2O。3.配比型当一种反应物中有两种或两种以上组成离子参与反应时,因其组成比例不协调(一般为复盐或酸式盐),当一种组成离子恰好完全反应时,另一种组成离子不能恰好完全反应(有剩余或不足)而跟用量有关。(1)Ca(HCO3)2溶液与NaOH溶液:NaOH不足:NaOH过量:Ca2++HCO-3+OH-===CaCO3↓+H2O;Ca2++2HCO-3+2OH-===CaCO3↓+2H2O+CO2-3。本课栏目开关(2)NaHSO4溶液与Ba(OH)2溶液溶液呈中性时:SO2-4完全沉淀时:2H++SO2-4+2OH-+Ba2+===BaSO4↓+2H2O;H++SO2-4+Ba2++OH-===H2O+BaSO4↓。本课栏目开关规律方法·解题指导高考热点“高频误写”离子方程式的诊断与突破判断下列离子方程式的书写是否正确?并把错误的改正。1.NaHCO3溶液水解:HCO-3+H2OCO2-3+H3O+2.将Na投入到CuSO4溶液中:2Na+Cu2+===2Na++Cu↓3.氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+===Fe3++3H2O4.F2与NaOH溶液反应:F2+4OH-===2F-+O2+2H2O5.硫酸氢钠溶液与足量氢氧化钡溶液混合:2H++SO2-4+Ba2++2OH-===BaSO4↓+2H2O6.用惰性电极电解MgCl2溶液:2Cl-+2H2O=====电解Cl2↑+H2↑+2OH-第2讲本课栏目开关规律方法·解题指导7.向小苏打溶液中加入过量的澄清石灰水:2HCO-3+Ca2++2OH-===CaCO3↓+2H2O+CO2-38.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2OFe(OH)3+3H+9.将少量SO2气体通入NaClO溶液中:SO2+H2O+ClO-===SO2-4+Cl-+2H+10.FeCl3溶液腐蚀铜电路板:Fe3++Cu===Cu2++Fe2+11.Cl2通入水中:Cl2+H2O===2H++Cl-+ClO-第2讲本课栏目开关规律方法·解题指导答案1.错;HCO-3+H2OH2CO3+OH-2.错;2Na+Cu2++2H2O===2Na++H2↑+Cu(OH)2↓3.错;2Fe(OH)3+6H++2I-===2Fe2++I2+6H2O4.错;2F2+4OH-===4F-+O2+2H2O5.错;H++SO2-4+Ba2++OH-===BaSO4↓+H2O6.错;Mg2++2Cl-+2H2O=====电解Cl2↑+H2↑+Mg(OH)2↓7.错;HCO-3+Ca2++OH-===CaCO3↓+H2O8.错;Fe3++3H2O=====△Fe(OH)3(胶体)+3H+9.错;SO2+H2O+3ClO-===SO2-4+Cl-+2HClO10.错;2Fe3++Cu===2Fe2++Cu2+11.错;Cl2+H2OH++Cl-+HClO第2讲本课栏目开关规律方法·解题指导反思归纳判断离子方程式正误“四字真经”——“四查、三看”四查:一查化学符号书写是否正确;二查“===”、“”、“↑”、“↓”是否恰当;三查是否符合三个守恒:质量守恒、电荷守恒和得失电子守恒;四查是否符合客观事实。三看:一看反应是否在溶液中进行;二看物质的溶解性;三看反应的可能性是否为多种离子参加的多种不同的反应。第2讲本课栏目开关真题重组·规范集训真题重组·规范集训高考题组一常见离子方程式的正误判断1.判断下列离子方程式是否正确,正确的划“√”,错误的划“×”(1)FeCl3溶液与Cu的反应:Cu+Fe3+===Cu2++Fe2+()(2011·江苏,6A)×(2)NO2与水的反应:3NO2+H2O===2NO-3+NO+2H+()(2011·江苏,6B)√第2讲本课栏目开关真题重组·规范集训(3)醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+===Ca2++H2O+CO2↑()(2011·江苏,6C)解析CH3COOH为弱酸,不能拆开写。×(4)硫化亚铁溶于稀硝酸中:FeS+2H+===Fe2++H2S↑()(2011·课标全国卷,12A)×解析稀硝酸具有强氧化性。(5)大理石溶于醋酸中:CaCO3+2CH3COOH===Ca2++2CH3COO-+CO2↑+H2O()(2011·课标全国卷,12D)√第2讲本课栏目开关真题重组·规范集训2.(2010·大纲全国卷Ⅱ,6)下列反应中,可用离子方程式H++OH-===H2O表示的是()A.NH4Cl+NaOH=====△NaCl+NH3↑+H2OB.Mg(OH)2+2HCl===MgCl2+2H2OC.NaOH+NaHCO3===Na2CO3+H2OD.NaOH+HNO3===NaNO3+H2OD解析A项的离子方程式为NH+4+OH-=====△NH3↑+H2O;B项写成离子方程式时,Mg(OH)2写成分子形式;C项的离子方程式为OH-+HCO-3===H2O+CO2-3。第2讲本课栏目开关真题重组·规范集训3.(2010·大纲全国卷Ⅰ,8)能正确表示下列反应的离子方程式是()A.将铁粉加入稀硫酸中:2Fe+6H+===2Fe3++3H2↑B.将磁性氧化铁溶于盐酸:Fe3O4+8H+===3Fe3++4H2OC.将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO-3===Fe3++2H2O+NO↑D.将铜屑加入Fe3+溶液中:2Fe3++Cu===2Fe2++Cu2+第2讲本课栏目开关真题重组·规范集训解析A项,铁与稀硫酸反应,铁元素被氧化为+2价,正确的离子方程式为Fe+2H+===Fe2++H2↑;B项,磁性氧化铁中有三分之二的三价铁、三分之一的二价铁,故其正确的离子方程式为Fe3O4+8H+===2Fe3++Fe2++4H2O;C项,因为硝酸具有强氧化性,能将亚铁离子氧化为三价铁离子,但该方程式没配平,各物质在方程式中的化学计量数应分别为3、4、1、3、2、1;D项,三价铁离子具有强氧化性,能将铜氧化,自身被还原为二价铁离子,D正确。答案D第2讲本课栏目开关真题重组·规范集训4.(2010·天津理综,5)下列实验设计及其对应的离子方程式均正确的是()A.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+===Cu2++2Fe2+B.Na2O2与H2O反应制备O2:Na2O2+H2O===2Na++2OH-+O2↑C.将氯气溶于水制备次氯酸:Cl2+H2O===2H++Cl-+ClO-D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO-4+6H++5H2O2===2Mn2++5O2↑+8H2O第2讲本课栏目开关真题重组·规范集训解析Fe3+可以氧化Cu形成Cu2+,A项正确;Na2O2与H2O反应的离子方程式应为2Na2O2+2H2O===4Na++4OH-+O2↑,B项错误;氯气与水反应的离子方程式为Cl2+H2OH++Cl-+HClO,C项错误;不能用浓盐酸酸化高锰酸钾溶液,因为高锰酸钾溶液也可氧化浓HCl生成Cl2,KMnO4溶液褪色不能证明是H2O2的还原性所致,D项错误。答案A第2讲本课栏目开关真题重组·规范集训5.(2010·北京理综,10)下列解释实验事实的方程式不准确的是()A.0.1mol·L-1CH3COOH溶液的pH>1:CH3COOHCH3COO-+H+B.“NO2球”浸泡在冷水中,颜色变浅:2NO2(g)N2O4(g)ΔH<0(红棕色)(无色)C.铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO-3===3Fe2++2NO↑+4H2OD.向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO2-3+H2OHCO-3+OH-解析铁溶于稀硝酸,溶液变黄,应该生成Fe3+,C错误。C第2讲本课栏目开关真题重组·规范集训6.(2010·江苏,3)下列离子方程式表达正确的是()A.用惰性电极电解熔融氯化钠:2Cl-+2H2O=====通电Cl2↑+H2↑+2OH-B.用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-===2AlO-2+H2OC.用稀氢氧化钠溶液吸收二氧化氮:2OH-+2NO2===NO-3+NO↑+H2OD.用食醋除去水瓶中的水垢:CO2-3+2CH3COOH===2CH3COO-+CO2↑+H2O第2讲本课栏目开关真题重组·规范集训解析电解熔融氯化钠,没有水参加反应,A错误;铝表面的氧化膜Al2O3能溶于强碱NaOH溶液中,生成NaAlO2,B正确;。C项中反应前后电荷不守恒,错误;水垢中的成分之一CaCO3难溶于水,在离子方程式中不能拆分为离子形式,D错误。答案B第2讲本课栏目开关真题重组·规范集训7.(2009·广东理基,32)下列离子方程式正确的是()A.铁与稀HNO3反应:Fe+2H+===Fe2++H2↑B.小苏打与氢氧化钠溶液混合:HCO-3+OH-===CO2↑+H2OC.氯化钙与碳酸氢钾溶液混合:Ca2++CO2-3===CaCO3↓D.CuSO4溶液与Ba(OH)2溶液混合:Cu2++SO2-4+2OH-+Ba2+===BaSO4↓+Cu(OH)2↓D解析铁与稀HNO3反应不产生H2,而是NO气体,A项错;HCO-3与OH-生成CO2-3,而不是CO2,B项错;碳酸氢钾应拆写成K+、HCO-3,C项错;D项,生成两种沉淀,正确。第2讲本课栏目开关真题重组·规范集训题组二与“量”有关的离子方程式的正误判断8.判断下列离子方程式是否正确,正确的划“√”,错误的划“×”。(1)向NaAlO2溶液中通入过量CO2:2AlO-2+CO2+3H2O===2Al(OH)3↓+CO2-3()(2011·江苏,6D)×解析产物不对,应生成HCO-3。(2)少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O===C6H5OH+HSO-3()(2011·新课标全国卷,12C)×解析应生成SO2-3。第2讲本课栏目开关真题重组·规范集训(3)醋酸钠水溶液中通入足量CO2:2CH3COO-+CO2+H2O===2CH3COOH+CO2-3()(2010·海南,10C)×(4)FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2===2Fe3++4Cl-+Br2()(2010·课标全国卷,13D)(5)等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合Ca2++2HCO-3+2OH-―→CaCO3↓+CO2-3+2H2O()(2010·上海,19B)××第2讲本课栏目开关真题重组·规范集训9.(2011·上海,21改编)在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是()A.Fe2++SO2-4+Ba2++2OH-―→BaSO4↓+Fe(OH)2↓B.NH+4+Fe3++2SO2-4+2Ba2++4OH-―→2BaSO4↓+Fe(OH)3↓+NH3·H2OC.2Fe3++3SO2-4+3Ba2++6OH-―→3BaSO4↓+Fe(OH)3↓D.3NH+4+Fe3++3SO2-4+3Ba2++6OH-―→3BaSO4↓+Fe(OH)3↓+3NH3·H2OB第2讲本课栏目开关真题重组·规范集训10.(2010·四川理综,9)下列离子方程式书写正确的是()A.向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO2-4+2Ba2++4OH-===2BaSO4↓+AlO-2+2H2OB.向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+===Fe2++2H2OC.向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:NH+4+OH-NH3·H2OD.向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-――→△CH2BrCOO-+H2O第2讲本课栏目开关真题重组·规范集训解析本题考查离子方程式正误判断。氢氧化钡溶液过量,Al3+转化为AlO-2,SO2-4完全转化为沉淀,A项正确;硝酸有强氧化性,可将Fe2+氧化为Fe3+,硝酸被还原为NO,B不符合客观事实,错误;在磷酸二氢铵溶液中加入足量的氢氧化钠溶液,磷酸二氢根离子中的氢将被中和,C项错误;CH2BrCOOH中存在两种官能团,分别是—Br和—COOH,加入足量的氢氧化钠溶液后加热,与—COOH发生中和反应,与—Br发生水解反应,故应该生成CH2OHCOO-,D项错误。答案A第2讲本课栏目开关真题重组·规范集训规范答题离子方程式的答题规范考生答卷案例——找错纠错第2讲本课栏目开关真题重组·规范集训规范答案1.溶液由紫红色变为无色无色溶液中出现黄色沉淀还原性氧化性5SO2+2MnO-4+2H2O===2Mn2++5SO2-4+4H+2.2Al+2OH-+2H2O===2AlO-2+3H2↑3.(1)2Fe2++2Br-+2Cl2===2Fe3++4Cl-+Br2(2)2I-+Cl2===I2+2Cl-(3)Ba2++2OH-+SO2-4+Cu2+===Cu(OH)2↓+BaSO4↓(4)HCO-3+OH-===H2O+CO2-3(5)Fe3++3H2OFe(OH)3+3H+(6)Al3++3NH3·H2O===Al(OH)3↓+3NH+4第2讲本课栏目开关



















