







《化学平衡常数的计算PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为555.5 KB,总共有14页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 14页
- 555.5 KB
- VIP模板
- ppt
- 数字产品不支持退货
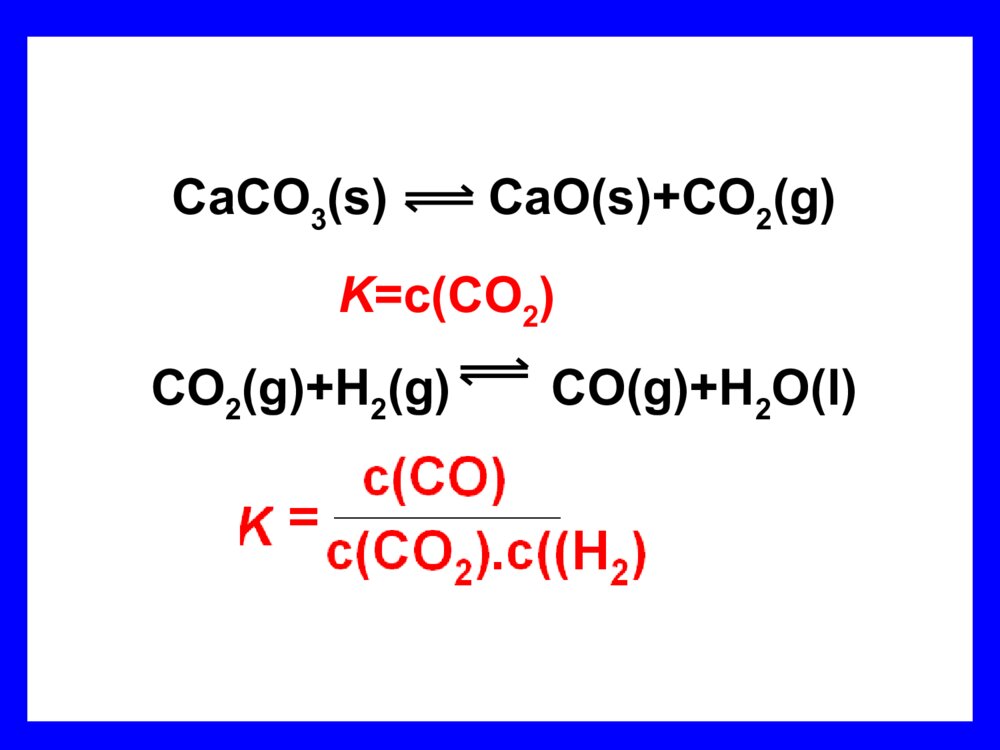
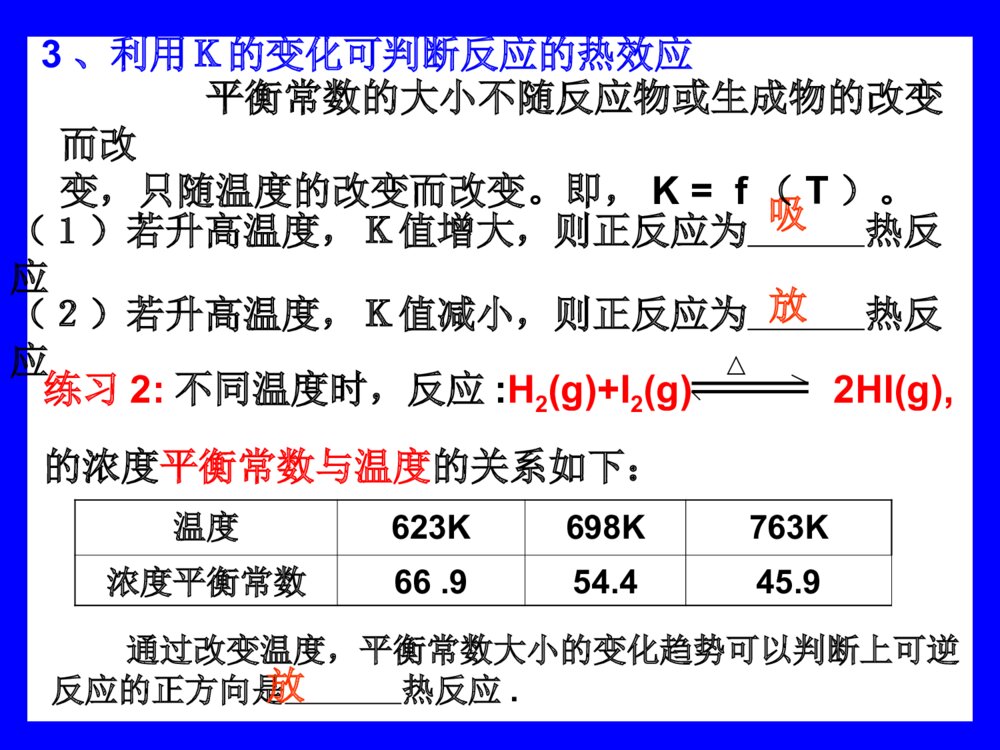
通过分析实验数据得出:1、温度不变时,为常数用K表示;2、常数K与反应的起始浓度大小无关;3、常数K与正向建立还是逆向建立平衡无关即与平衡建立的途径无关。其它平衡体系的数据进行分析,都有类似的关系。对于反应:aA+bBcC+dD)()()()(BcAcDcCcKbadc练习1:试写出下列反应的浓度平衡常数的数学表达式:2SO2(g)+O2(g)2SO3C(s)+H2O(g)CO(g)+H2(g)催化剂)()()(22232OcSOcSOcK)()()(22OHcHcCOcKCaCO3(s)CaO(s)+CO2(g)CO2(g)+H2(g)CO(g)+H2O(l)K=c(CO2)归纳总结使用平衡常数应注意的问题:(1)化学平衡常数只受温度影响,与反应物或生成物的浓度变化无关。C(s)+H2O(g)CO(g)+H2(g)FeO(s)+CO(g)Fe(s)+CO2(g)(3)化学平衡常数表达式与化学方程式的书写方式有关(2)在平衡常数表达式中,水(液态)的浓度、固体物质的浓度不写。K=cCO·cH2cH2OK=cCO2cCOK1=K22K2·K3=1K1·K23=1例1:C(s)+CO2(g)2CO(g)KC(s)+H2O(g)CO(g)+H2(g)K1CO(g)+H2O(g)CO2(g)+H2(g)K2K=K1/K2(4)、平衡常数只表现反应进行的程度,即可能性问题,而不表现到达平衡所需的时间,即现实性问题.(5)、平衡常数K与温度有关,与浓度无关,由K随温度的变化可推断正反应是吸热反应还是放热。若正反应是吸热反应,升高温度,K增大;若正反应是放热反应,升高温度,K减少;(5)K值大小标志反应能达到的最大限度,K值大,反应完全。返回播放http://www.flash8.net/upload/2003/7/12/20037121424166069.swfhttp://www.365520.com/flash/moreopen.asp?id=31175.小结:(1)平衡是有条件的、动态的。(2)K与起始浓度和反应途径无关。(3)K只是温度的函数(即只与温度有关)(4)K与方程式写法有关。(1)K值越大,表示反应进行的程度。二化学平衡常数的意义:(2)当K≥105时,反应进行的程度很大,反应基本完全。当K≤10-5时,反应进行的程度很小,反应很难进行。K居中,典型的可逆反应,改变条件反应的方向变化。1、定量的衡量化学反应进行的程度越大越大%100)()()(%100)()()(始平始始平始转化率cccnnn(3)思考1:1、K与a的关系;反应进行的程度越大,K值,反应物转化率也。2、K与v的关系;K值大,速率大,越大不一定对于可逆反应,在一定的温度的任意时刻,生成物浓度幂之积与反应物浓度幂之积的比值叫浓度商浓度商:(1)QC<K,反应向方向进行(2)QC=K,反应方向进行(3)QC>K,反应向方向进行正不移动逆2、判断化学反应进行的方向3、利用K的变化可判断反应的热效应(1)若升高温度,K值增大,则正反应为热反应(2)若升高温度,K值减小,则正反应为热反应吸放练习2:不同温度时,反应:H2(g)+I2(g)2HI(g),的浓度平衡常数与温度的关系如下:△温度623K698K763K浓度平衡常数66.954.445.9通过改变温度,平衡常数大小的变化趋势可以判断上可逆反应的正方向是热反应.放平衡常数的大小不随反应物或生成物的改变而改变,只随温度的改变而改变。即,K=f(T)。三、有关平衡常数的简单计算:利用平衡常数,可以求平衡时各组分的浓度(含量)和反应物的转化率例题2:在773K时:CO(g)+H2O(g)CO2(g)+H2(g),平衡常数K=1,如反应开始时CO和H2O的浓度都是0.020mol/l,计算该条件下CO的转化率最大是多少?例题2:在773K时:CO(g)+H2O(g)CO2(g)+H2(g),平衡常数K=1,如反应开始时CO和H2O的浓度都是0.020mol/l,计算该条件下CO的转化率最大是多少?起始浓度:0.0200.02000转化浓度:xxxx平衡浓度:0.020-x0.020-xxx解得:x=0.010(mol·L-1)解:设平衡时CO2和H2的浓度为xmol·L-1K=————=1x2(0.020-x)2CO(g)+H2O(g)CO2(g)+H2(g)转化率=——×100=50%0.0100.020答:该条件下CO的转化率最大为50%(mol/l)2、利用平衡常数,求平衡时反应物的转化率例3:反应SO2(g)+NO2(g)SO3(g)+NO(g),若在一定温度下,将物质的量浓度均为2mol/L的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,试求:在该温度下。(1)此反应的化学平衡常数(2)若SO2(g)的初始浓度增大到3mol/L,则它们的转化率变为多少?结论:在一定温度的密闭容器中,对于可逆反应,增加一种反应物的量(或浓度),该反应物转化率下降,另外一种反应物转化率升高。【课后思考】在一定温度的密闭容器中,对于反应CO(g)+2H2(g)CH3OH(g),(1)将容器的体积扩大两倍,该平衡向哪个方向移动?(2)保持H2的浓度不改变将容器的体积扩大两倍,该平衡向哪个方向移动?



















