





《化学药品研发流程PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为712.5 KB,总共有38页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 38页
- 712.5 KB
- VIP模板
- ppt
- 数字产品不支持退货
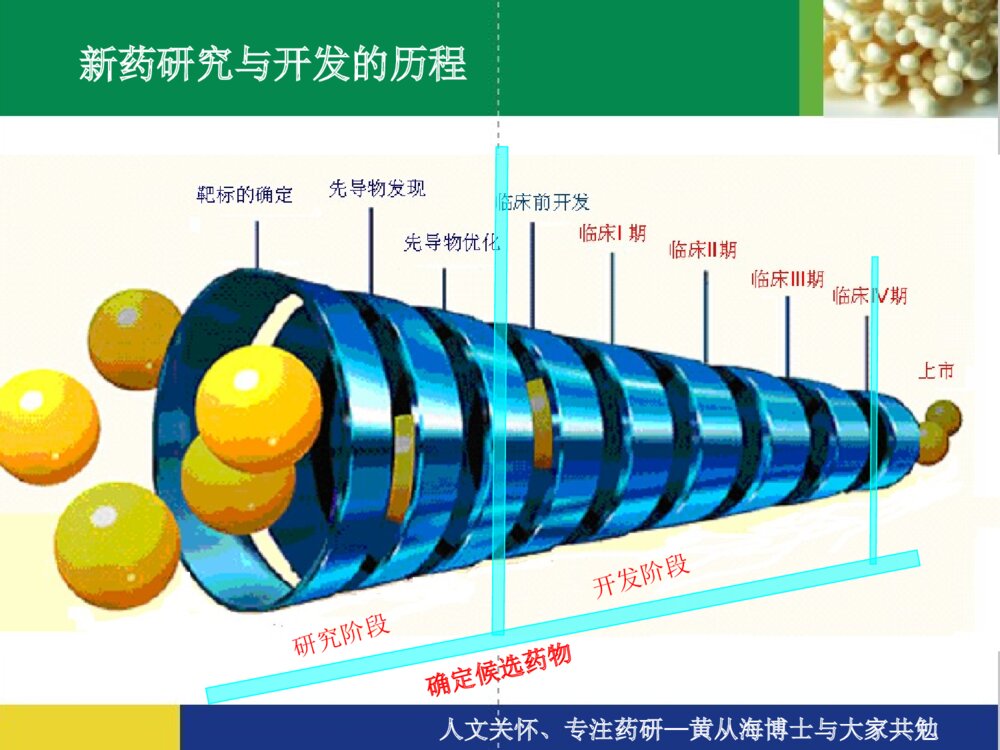
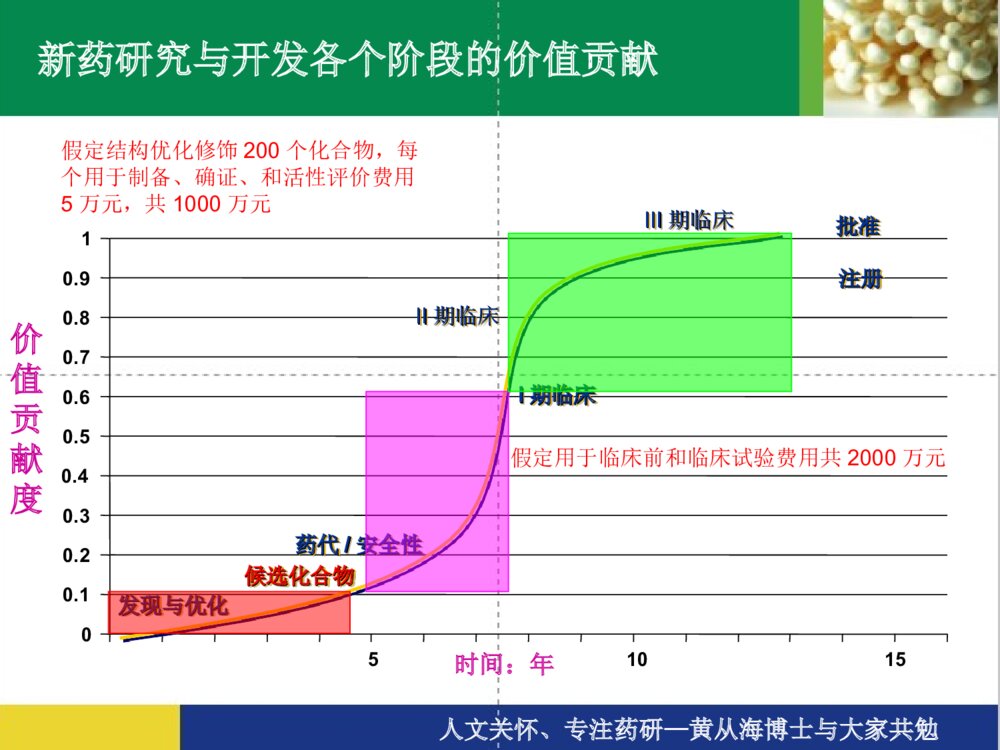
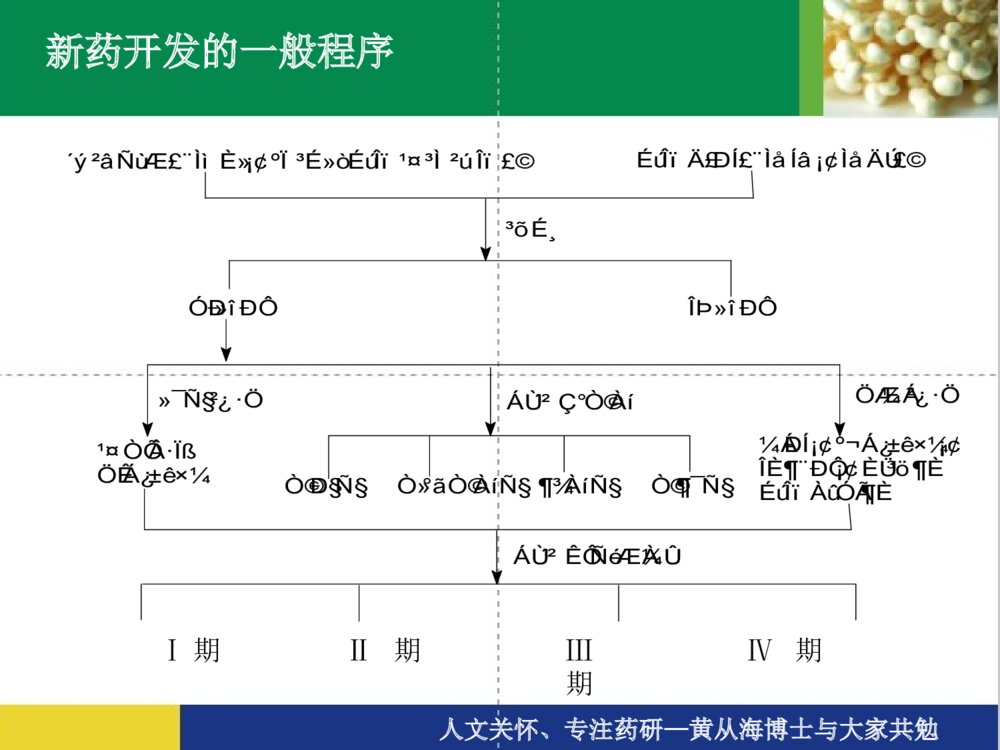
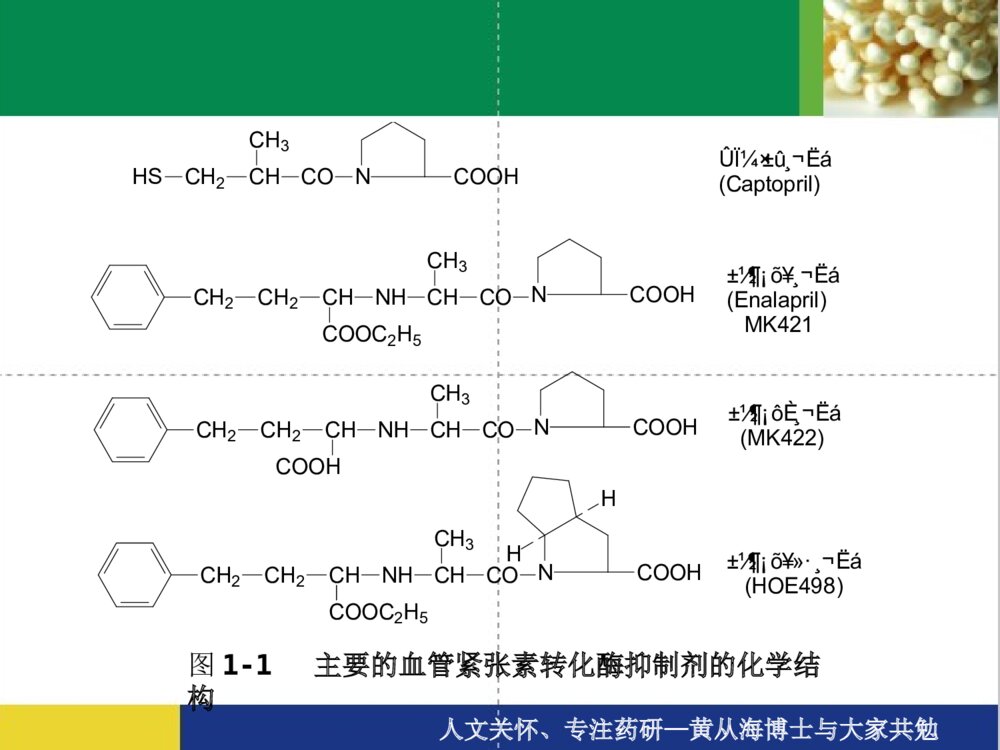
新药的研发过程新药的研发过程人文关怀、专注药研—黄从海博士与大家共勉新药研究与开发的历程新药的分类(SFDA)新药开发的一般程序新药研发的六个主要步骤一、研发靶标的确立、新药物实体的发现和确立二、临床前研究三、研究新药申请(IND,即申请临床试验)四、临床试验+临床前研究(继续)补充五、新药申请(NDA)六、上市及监测人文关怀、专注药研—黄从海博士与大家共勉新药研究与开发的历程确定候选药物研究阶段开发阶段人文关怀、专注药研—黄从海博士与大家共勉00.10.20.30.40.50.60.70.80.91候选化合物候选化合物药代药代//安全性安全性批准批准IIII期临床期临床注册注册II期临床期临床发现与优化发现与优化51015价值贡献度时间:年新药研究与开发各个阶段的价值贡献IIIIII期临床期临床假定结构优化修饰200个化合物,每个用于制备、确证、和活性评价费用5万元,共1000万元假定用于临床前和临床试验费用共2000万元人文关怀、专注药研—黄从海博士与大家共勉新药的分类(SFDA)中药、天然药物注册分类1、未在国内上市销售的中药、天然药物中提取的有效成份及其制剂;2、未在国内上市销售的来源于植物、动物、矿物等药用物质制成的制剂;3、中药材的代用品;4、未在国内上市销售的中药材新的药用部位制成的制剂;5、未在国内上市销售的从中药、天然药物中提取的有效部位制成的制剂;6、未在国内上市销售的由中药、天然药物制成的复方制剂;7、未在国内上市销售的由中药、天然药物制成的注射剂;8、改变国内已上市销售药品给药途径的制剂;9、改变国内已上市销售药品剂型的制剂;10、改变国内已上市销售药品工艺的制剂;11、已有国家标准的中成药和天然药物制剂。人文关怀、专注药研—黄从海博士与大家共勉新药的分类(SFDA)化学药品注册分类1、未在国内外上市销售的药品:(1)通过合成或者半合成的方法制得的原料药及其制剂;(2)天然物质中提取或者通过发酵提取的新的有效单体及其制剂;(3)用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂;(4)由已上市销售的多组份药物制备为较少组份的药物;(5)新的复方制剂;2、改变给药途径且尚未在国内外上市销售的制剂;3、已在国外上市销售但尚未在国内上市销售的药品:(1)已在国外上市销售的原料药及其制剂;(2)已在国外上市销售的复方制剂(3)改变给药途径并已在国外上市销售的制剂。4、改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂。5、改变国内已上市销售药品的剂型,但不改变给药途径的制剂。6、已有国家药品标准的原料药或者制剂。人文关怀、专注药研—黄从海博士与大家共勉新药的分类(SFDA)生物制品注册分类 1.未在国内外上市销售的生物制品。 2.单克隆抗体。 3.基因治疗、体细胞治疗及其制品。 4.变态反应原制品。 5.由人的、动物的组织或者体液提取的,或者通过发酵制备的具有生物活性的多组份制品。 6.由已上市销售生物制品组成新的复方制品。 7.已在国外上市销售但尚未在国内上市销售的生物制品。 8.含未经批准菌种制备的微生态制品。 9.与已上市销售制品结构不完全相同且国内外均未上市销售的制品(包括氨基酸位点突变、缺失,因表达系统不同而产生、消除或者改变翻译后修饰,对产物进行化学修饰等)。 10.与已上市销售制品制备方法不同的制品(例如采用不同表达体系、宿主细胞等)。 11.首次采用DNA重组技术制备的制品(例如以重组技术替代合成技术、生物组织提取或者发酵技术等)。 12.国内外尚未上市销售的由非注射途径改为注射途径给药,或者由局部用药改为全身给药的制品。 13.改变已上市销售制品的剂型但不改变给药途径的生物制品。 14.改变给药途径的生物制品(不包括上述12项)。 15.已有国家药品标准的生物制品。人文关怀、专注药研—黄从海博士与大家共勉新药开发的一般程序´ý²âÑùÆ·£¨ÌìÈ»¡¢ºÏ³É»òÉúÎ﹤³Ì²úÎÉúÎïÄ£ÐÍ£¨ÌåÍâ¡¢ÌåÄÚ£©³õɸÓлîÐÔÎÞ»îÐÔ»¯Ñ§²¿·ÖÁÙ´²Ç°Ò©ÀíÖƼÁ²¿·Ö¹¤ÒÕ·ÏßÖÊÁ¿±ê׼ҩЧѧһ°ãÒ©Àíѧ¶¾Àíѧҩ¶¯Ñ§¼ÁÐÍ¡¢º¬Á¿±ê×¼¡¢Îȶ¨ÐÔ¡¢Èܳö¶ÈÉúÎïÀûÓöÈÁÙ´²ÊÔÑéÆÀ¼ÛⅠ期Ⅱ期Ⅲ期Ⅳ期人文关怀、专注药研—黄从海博士与大家共勉发现新药的途径•定向筛选:设计某一特定的疾病模型或观察指标;设计、合成一定结构的化合物进行筛选;•广泛筛选:有目的、有针对性的对大量样品进行广泛的活性筛选,以供进一步研究,如化学药物所用的高通量筛选、生物菌株等的广泛筛选等;•一药多筛:建立模拟人类疾病的动物实验模型,即筛选系统,对每样品进行系统筛选;•药效关系研究:化学结构相似或立体结构相似的化合物,可能具有相似或相反的生物活性。(图1-1,1-2);•新方法、新技术:评价生物活性的新方法、新技术,对于发现新的活性物质致关重要;如对高通量筛选的反思、对现有评价思路的反思和发展(药效、药代效果甚至制剂方法等的综合考量);•偶然发现。建立在大量的研发工作和细心全面的总结的基础上,如“伟哥”的发现。人文关怀、专注药研—黄从海博士与大家共勉HSCH2CHCOCH3NCOOHÛϼױû¸¬Ëá(Captopril)NCOOHCH2CH2CHNHCOOC2H5CHCOCH3NCOOHCH2CH2CHNHCOOHCHCOCH3NCOOHCH2CH2CHNHCOOC2H5CHCOCH3HH±½¶¡õ¥¸¬Ëá(Enalapril)MK421±½¶¡ôȸ¬Ëá(MK422)±½¶¡õ¥»·¸¬Ëá(HOE498)图1-1主要的血管紧张素转化酶抑制剂的化学结构人文关怀、专注药研—黄从海博士与大家共勉HH7C3OH2CH2COOCNO2NHH3CCH3COOCH2CH2OC3H7Äá³µÄƽ£¨Niludipine£©NO2NHH3COOCCOOCH3H3CCH3HÏõ±½ßÁण¨Nifodipine£©Äá³µÄƽ£¨Nimodipine£©NO2NHH3CCH3HCOOCH2CH2OCH3HCOOCH3CH3C图1-2主要二氢吡啶类钙拮抗剂的化学结构人文关怀、专注药研—黄从海博士与大家共勉新药研发的六个主要步骤一、研发靶标的确立、新药物实体的发现和确立二、临床前研究三、研究新药申请(IND,即申请临床试验)四、临床试验+临床前研究(继续)补充五、新药申请(NDA)六、上市及监测人文关怀、专注药研—黄从海博士与大家共勉一、研发靶标的确立、新药物实体的发现和确立根据化学或生物学药物设计、天然药物、生物药物既有的经验理论、偶然的发现或现有临床的经验启发等等确立研发靶标及新药物实体(化学或生物实体)的来源方案天然物的提取和筛选•植物:长春花——长春碱、长春新碱•太平洋红豆杉树——紫杉醇•动物:胰岛素、激素、天花疫苗有机合成和筛选–分子设计合成体外、体内的活性筛选特异性疾病动物模型筛选(药效、药代等)化合物结构优化再评价新化合物实体(NCE)既有药物的分子改造(药物的升级换代)头孢菌素:从第一代发展到第四代,其抗菌范围和抗菌活性也不断扩大和增强。生物制品实体的设计、发现和筛选其他途径:如既有药物的适应症的拓展和转变、复方的研发等人文关怀、专注药研—黄从海博士与大家共勉二、临床前研究化学或生物实体的工艺研发及产品制备开发出符合新药申报要求的化合物实体制备工艺研发,并按照该工艺制备足够量的化合物实体(药物)用以临床前试验、临床研究、小规模和大规模制剂制备等等,每一步必须进行质量控制和验证。生物学特性研发及方案确立•药理学•药代动力学•毒理学处方研究•物化性质•最初的处方设计人文关怀、专注药研—黄从海博士与大家共勉化学或生物实体的工艺研发及产品制备该部分为确立(化学、生物)药物实体后临床前研发的主体工作;该部分研发是系统的体系,需要严格依据相应指导原则等的要求,过程和结果必须符合指导原则、结果必须考虑放大和生产的可能性、药品的有效性和安全性(两方面都必须与既有的类似品种对照)、原料药/制剂/药理药代的过程系统配合和效果融合等等;研发过程中不断的判断宏微观效果、并作方案的调整、优化和再评价,并在不同的阶段作出相应的决策。人文关怀、专注药研—黄从海博士与大家共勉ProjectevaluationProjectinitationLaboratoryAPI&StandardsAvailableTechnologyTransferInitialresearchProcess&AnalyticalDevelopmentCompleteProductionOfQualificationBatchesAPI’sR&DAvaliable•Patent&literaturereview•Rawmateralsourcing•Establishprojectteam•SyntheticRouteSelection•ProductFormDefinition•ConfirmStrategy•Thedesignedrouterun-throughandcomfirmed•UnitOperationsOptimization(Crystallization,filtration,dryingetc.)•Yield/PurityEfficiencyOptimization•ImpuritiesIdetification/Synthesis•HazardStudiesAndWasteHanding/Recovery•AnalyticalDevelopment/Speciifications•Productionoflabbatches(atleast3batches)•CompilationOfTechnologyInformation•ReceivingLaboratoryVenfication•ImplementationPlannning•ImplementationEngineening•AlltheCTDfilespreparationAPIR&DMILESTONES人文关怀、专注药研—黄从海博士与大家共勉生物学特性研发及方案确立目的判断一个化合物是否具有足够的安全性和有效性,使之继续成为一个有前景的新药,必须经过全面研究以获得有关药效;如何吸收、在体内的整个分布/积蓄/代谢/排泄的情况;以及如何作用于机体的细胞、组织和器官。参入范围需要应用于新药开发的生物学家、微生物学家、分子生物学家、生物化学家、遗传学家、药理学家、生理学家、药物动力学家、病理学家、毒理学家、统计学家等参与共同完成。人文关怀、专注药研—黄从海博士与大家共勉生物学特性之药理学与治疗作用有关的主要药效学研究一般药理学研究毒理学研究-急性毒性试验-大鼠长期毒性试验-犬长期毒性试验-皮肤刺激性试验-皮肤过敏试验-致突变试验-生殖毒性试验-致癌试验药物依赖性试验人文关怀、专注药研—黄从海博士与大家共勉受试样品:API相关事宜;实验动物:离体动物组织、整体动物试验(啮齿动物和非啮齿动物)实验方法:-体外实验:分子水平--酶系统工作-细胞水平:体外细胞培养和样品测试-组织、器官水平-整体动物实验实验分组:空白(模型)对照阳性药对照样品:低剂量、中剂量、高剂量给药方式:静脉注射(iv)、腹腔注射(ip)、口服(po)、皮下注射(sc)、灌胃(ig);生物统计处理与治疗作用有关的主要药效学研究人文关怀、专注药研—黄从海博士与大家共勉目的:了解新药主要药效作用以外的广泛药理作用。指导原则:“当发现一种化合物具有某种药理活性时,应进行广泛的动物药理学试验,以测定其是否具有任何可供治疗应用的作用”。“应在机体的主要器官系统上进行综述,以揭示药物的其它作用,不论这种作用是希望的,还是不希望的”。主要观察指标:1、精神神经系统2、心血管系统3、呼吸系统4、其它一般药理学研究人文关怀、专注药研—黄从海博士与大家共勉目的:观察受试样品一次给予动物后所引起的毒性反应和死亡情况。动物:样品:方法:剂量选择给药途径、体积观察指标结果:LD50或最大给药量Note:LD50是半数致死剂量,指在预定时间之内,如96h,导致50%被暴露个体死亡的剂量。常与ED50【半最大效应浓度】配合计算治疗指数LD50/ED50,用以评价药物的安全性,治疗指数大的药物相对安全。急性毒性试验人文关怀、专注药研—黄从海博士与大家共勉目的:观察受试样品连续给予动物后所引起的毒性反应和严重程度,提供毒性反应的靶器官及损害的可逆性,确定无毒反应剂量。动物:样品:方法:试验分组:对照组、低、中、高剂量动物数:给药方法:检测指标:一般观察、血液学、血液生化、尿液、系统尸解、组织病理学、心电图(只对犬)、其它;恢复性观察资料整理大鼠、犬长期毒性试验人文关怀、专注药研—黄从海博士与大家共勉目的:观察动物皮肤接触受试物后所产生的刺激反应情况。试验材料:动物受试物试验方法:用药后不同时间,观察用药部位红斑,水肿情况。结果判断:表1、2皮肤刺激试验人文关怀、专注药研—黄从海博士与大家共勉表1皮肤刺激反应评分刺激反应分值红斑:无红斑勉强可见中度红斑严重红斑紫红色红斑并有焦痂形成水肿:无水肿勉强可见皮肤隆起轮廓清楚水肿隆起约1mm并范围扩大012340124总分8表2皮肤刺激强度评价强度分值无刺激性〈0.5轻度刺激性<2.09中度刺激性<6.0强刺激性〈6.0人文关怀、专注药研—黄从海博士与大家共勉根据受试物的化学结构、理化性质及对遗传物质作用终点的不同,进行微生物回复突变试验、哺乳动物细胞染色体畸变试验、动物微核试验1、微生物回复突变试验组胺酸缺陷型鼠伤寒沙门氏菌样品(溶媒,阳性药)回变菌落数哺乳动物肝微粒体酸(S9)结果判定:(1)受试物诱发的回变菌落数增加,超过对照2倍,有量效关系。(2)某测试点超过对照2倍以上,可重复并有统计学意义。致突变试验48-72h人文关怀、专注药研—黄从海博士与大家共勉2、哺乳动物培养细胞染色体畸变试验中国仓鼠肺细胞样品(溶媒,阳性药)染色体畸变率S9结果判定:(1)受试物诱发的染色体畸变数的增加剂量相关。(2)某一侧试点呈现可重复的,并有统计学意义的增加。3、啮齿动物微核试验NIH小鼠—给样品(溶媒、阳性药)取骨髓、涂片、染色微核出现频度结果判定:(1)受试物诱发微核频率的增加与剂量相关。(2)某一测试点微核增加可呈重复,并有统计学意义的增加12-72h选合适选样时间计数1000个多染红细胞观察100个中期分裂相人文关怀、专注药研—黄从海博士与大家共勉1、一般生殖毒性试验设计:合笼前给药,♂,60-80d,♀,14d。孕后雌鼠继续给药至多数器官形成期。观察指标:一般状况,体重、受孕率、死胎数、活胎数及重量。外观及内脏和骨骼变化。2、致畸敏感期毒性试验设计:于胚胎器官形成期给药,大鼠孕后6-15d,小鼠6-15d,兔6-18d,20d处死动物。计录指标:孕鼠重、黄体数、死胎数、活胎数、活胎重、性别、外观、1/2胎仔作内脏检查,1/2胎仔作骨骼检查。3、围产期毒性试验设计:孕中后期开始给药,至产后21d(小鼠),28d(大鼠),31d(兔)。计录指标:母体及胎仔情况,包括子代生长发育情况。生殖毒性试验人文关怀、专注药研—黄从海博士与大家共勉1、短期致癌试验:哺乳动物培养细胞恶性转化试验、小鼠肺肿瘤诱发短期试验2、动物长期致癌试验?致癌试验人文关怀、专注药研—黄从海博士与大家共勉1、身体依赖性试验:自然戒断试验替代试验催促试验诱导试验2、精神依赖性试验??药物依赖性试验人文关怀、专注药研—黄从海博士与大家共勉生物学特性——药动学研究•ADME(吸收:absorption、分布:distribution、代谢:metabolism及排泄excretion)•方法:及时收集和分析尿液、血液和粪便样品及对动物解剖后的组织和器官。•目的:–药物从各种途径给药后的吸收程度和速度,包括一种推荐为人体给出药的途径–药物在体内的分布速度和药物滞留部位及持续的时间–药物在体内的代谢的速度、初级和次组位点及机理,以及代谢物化学性质和药理学。–药物从体内消除的比例及消除的速率和途径人文关怀、专注药研—黄从海博士与大家共勉药物在生物样品中的分离和测定1、灵敏度2、特异性3、重现性4、标准曲线、回收率5、待测样品测定药动学参数测定1、药时曲线2、主要参数静脉注射:t1/2(α)、t1/2(β)(分布)、K12、K10、Vd(表观分布容积)、CL(药物清除率)、AUC(AUC:AreaUnderCurve)血管外给药:Ka、t1/2、CL、Vd、Cmax(峰浓度)、Tmax(达峰时间)、AUC药物的分布药物的排泄血浆蛋白结合药动学研究侧重内容人文关怀、专注药研—黄从海博士与大家共勉处方研究•物化性质–溶解度–分配系数–溶解速率–物理形态–稳定性•拟定、研发最初处方I期临床试验期间,对于口服给药,直接应用仅含活性药物无其他药用辅料的胶囊剂。II期临床试验的处方通常含少量有药用辅料。在II期临床试验期间,最终的剂型被选择和开发作III期临床使用并代表了提交FDA上市申请的处方。人文关怀、专注药研—黄从海博士与大家共勉三、新药研究申请(InvestigationalNewDrugApplication,IND)•递交申请(临床研究方案)•SFDA(或其他)审核•发补、获得临床批件人文关怀、专注药研—黄从海博士与大家共勉病例数时间目的阶段成功率(%)I期临床20~100几个月安全性为主45II期临床几百几个月到2年某些短期安全性主要是有效性30III期临床几百~几千1~4年安全性、有效性和剂量5~10四、临床试验+临床前研究(继续)补充表:临床试验的分期NOTE:平均20个候选药物中的1个最终被批准上市(参考:FDAconsumer,1987;21:12)人文关怀、专注药研—黄从海博士与大家共勉临床前研究的继续(补充)•长期动物毒性•产品处方(在II期临床试验期间作最后的制剂处方优化)•生产和控制•包装和标签设计人文关怀、专注药研—黄从海博士与大家共勉五、新药申请(NDA)在临床前和临床研究完成以后,可以提交新药申请(NDA)以求获准上市新产品。–接受、获得受理号–SFDA(或FDA及其他)审核–工厂检查、现场核查–SFDA(或FDA及其他)决定人文关怀、专注药研—黄从海博士与大家共勉六、上市及监测•IV期临床研究和上市后监测–理解药物的作用机理和范围;–研究药物可能的新的治疗作用;–说明需要补充的剂量规格•上市后的药物副作用(Adversedrugreaction,ADR)报告–发现并在15个工作日内报告SFDA(或FDA及其他)•年度报告人文关怀、专注药研—黄从海博士与大家共勉ThanksQ&A



















