




《化学选修四·盐类的水解PPT课件下载(共78页)》是由用户上传到老师板报网,本为文库资料,大小为2.49 MB,总共有77页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 77页
- 2.49 MB
- VIP模板
- ppt
- 数字产品不支持退货
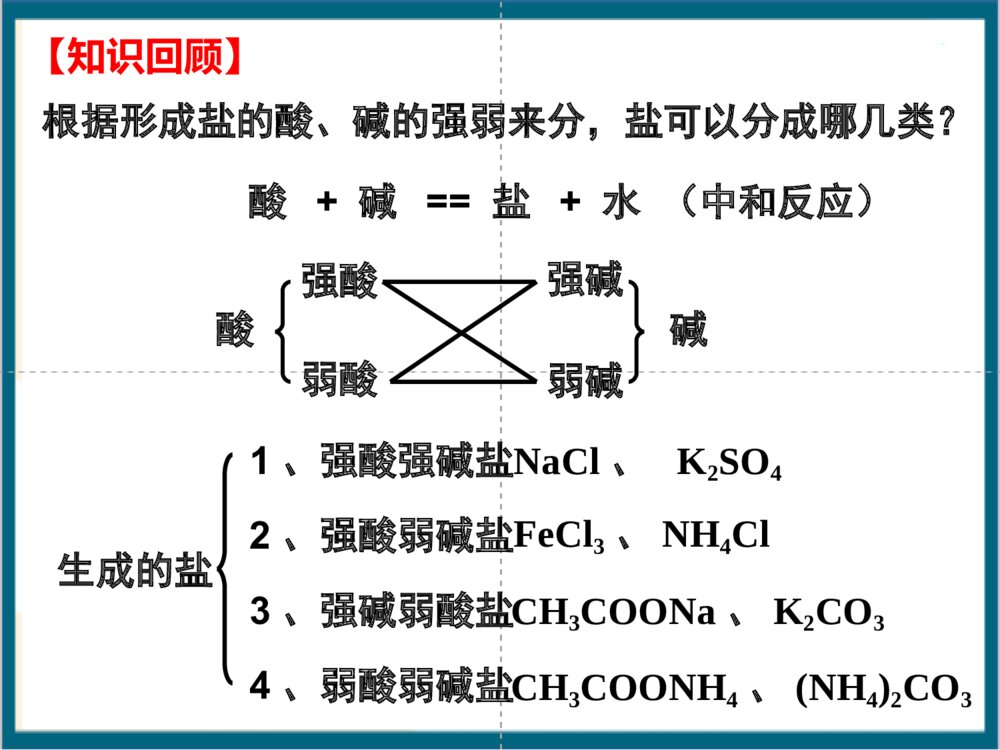
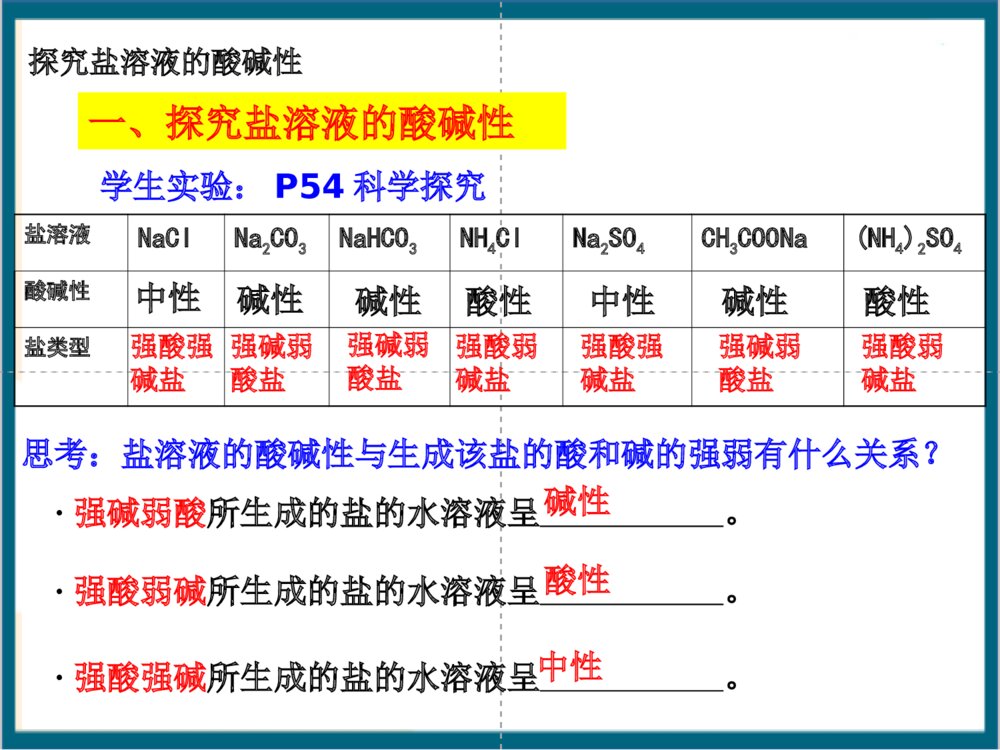
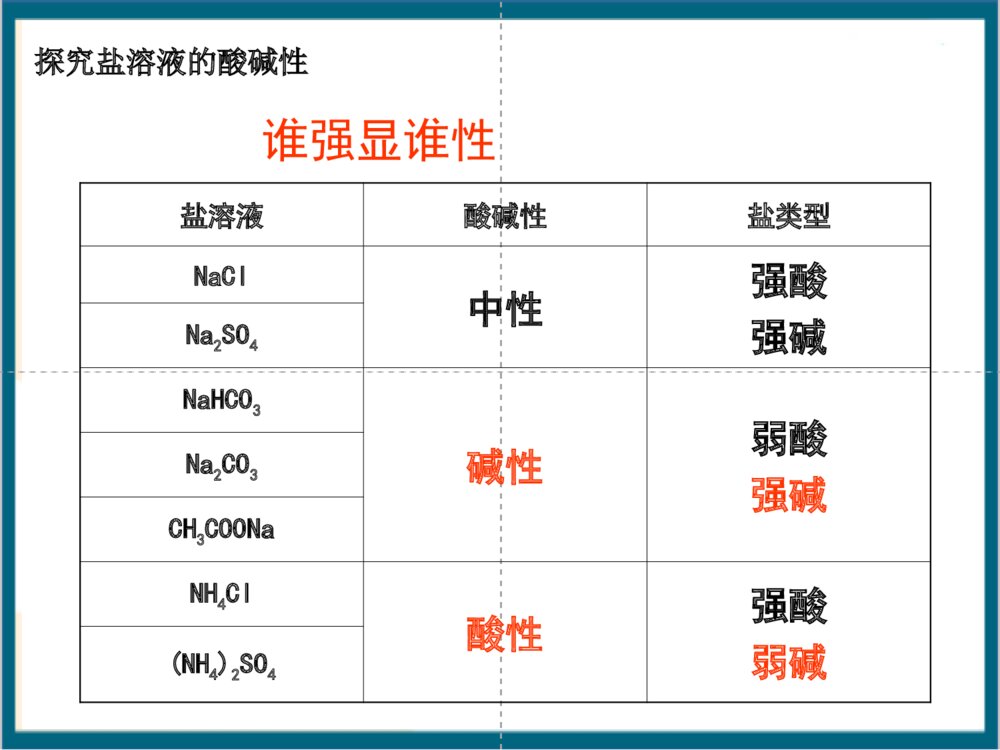
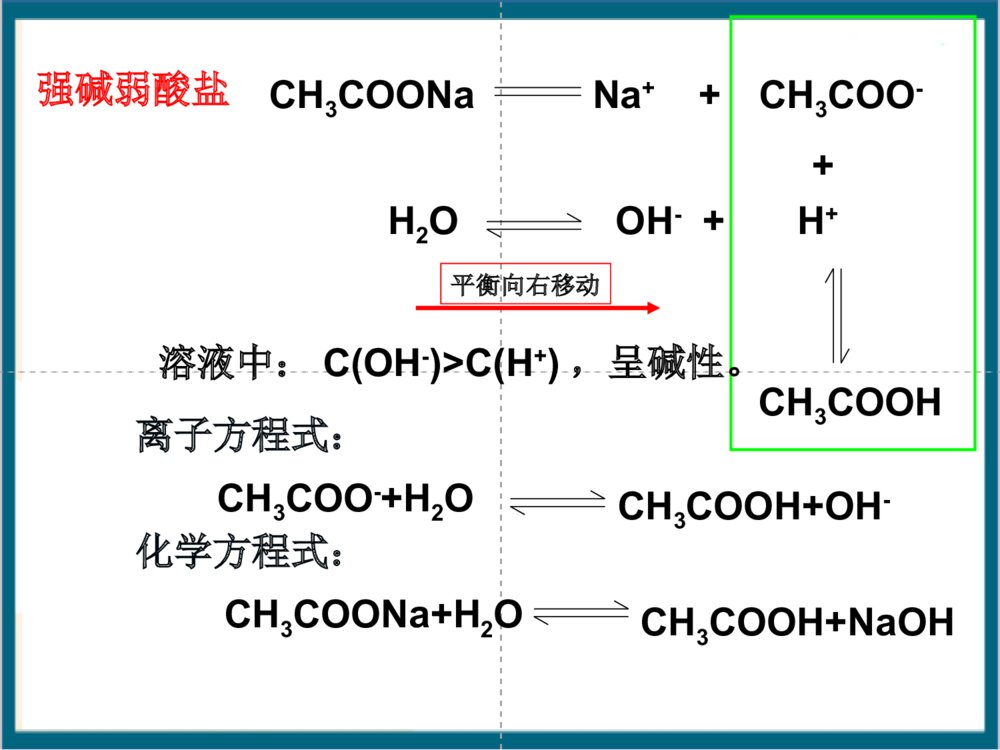
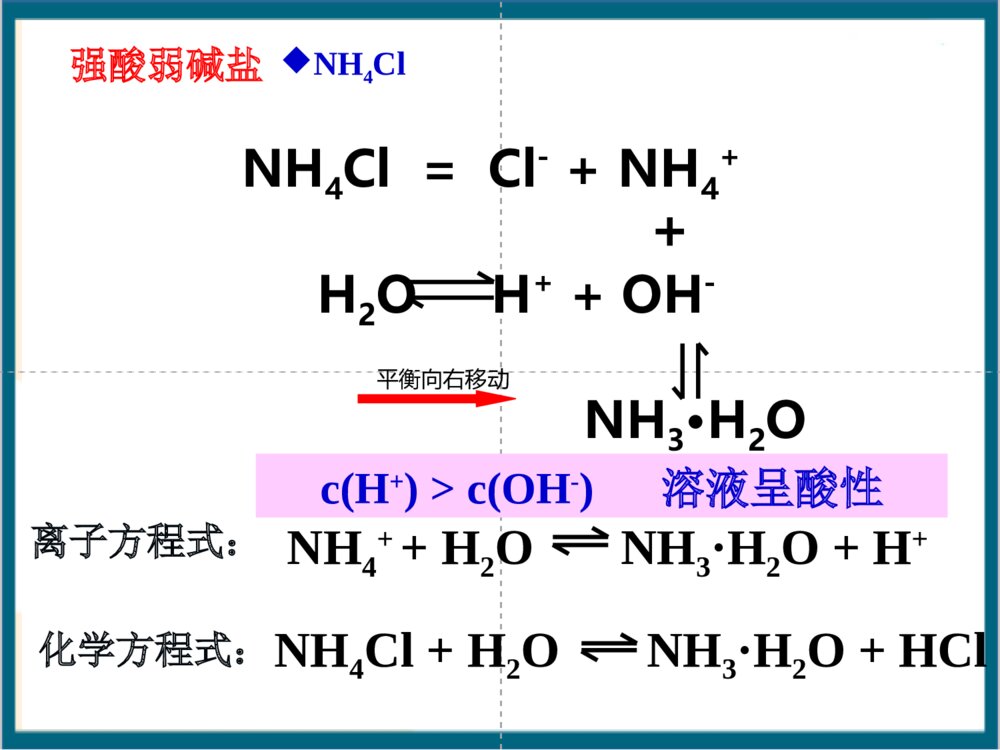
根据形成盐的酸、碱的强弱来分,盐可以分成哪几类?酸+碱==盐+水(中和反应)酸强酸弱酸弱碱强碱碱生成的盐1、强酸强碱盐2、强酸弱碱盐3、强碱弱酸盐4、弱酸弱碱盐NaCl、K2SO4FeCl3、NH4ClCH3COONH4、(NH4)2CO3CH3COONa、K2CO3【知识回顾】【回忆思考】Na2CO3俗称什么?分别往Na2CO3和NaHCO3的溶液中滴加酚酞,可观察到什么现象?NaHCO3溶液Na2CO3溶液一、探究盐溶液的酸碱性学生实验:P54科学探究盐溶液NaClNa2CO3NaHCO3NH4ClNa2SO4CH3COONa(NH4)2SO4酸碱性盐类型中性碱性碱性酸性中性碱性思考:盐溶液的酸碱性与生成该盐的酸和碱的强弱有什么关系?·强碱弱酸所生成的盐的水溶液呈。·强酸弱碱所生成的盐的水溶液呈。·强酸强碱所生成的盐的水溶液呈。强酸强碱盐强碱弱酸盐强碱弱酸盐强酸弱碱盐强酸强碱盐强碱弱酸盐碱性酸性中性酸性强酸弱碱盐探究盐溶液的酸碱性盐溶液酸碱性盐类型NaCl中性强酸强碱Na2SO4NaHCO3碱性弱酸强碱Na2CO3CH3COONaNH4Cl酸性强酸弱碱(NH4)2SO4谁强显谁性探究盐溶液的酸碱性盐溶液呈现不同酸碱性的原因H2OH++OH–纯水中:当分别加入CH3COONa、NH4Cl、NaCl形成溶液后,请思考:(1)相关的电离方程式?(2)盐溶液中存在哪些粒子?(3)哪些粒子间可能结合(生成弱电解质)?(4)对水的电离平衡有何影响?(5)相关的化学方程式?分析后,填写书P55表格CH3COONa溶液显碱性的原因:CH3COONa溶液中存在哪些电离?CH3COONa溶液中存在哪些离子?哪些微粒可能发生相互作用?CH3COONaCH3COO-H2OH++CH3COOH平衡向右移动Na++OH-+溶液中:C(OH-)>C(H+),呈碱性。CH3COO-+H2OCH3COOH+OH-CH3COONa+H2OCH3COOH+NaOH化学方程式:离子方程式:强碱弱酸盐CH3COONa溶于水时,CH3COONa电离出的CH3COO_和水电离出的H+结合生成难电离的CH3COOH,消耗了溶液中的H+,使水的电离平衡向右移动,产生更多的OH_,建立新平衡时,C(OH_)>C(H+),从而使溶液显碱性。NH4Cl=Cl-+NH4+H2OH++OH-+NH3·H2ONH4++H2ONH3·H2O+H+c(H+)>c(OH-)溶液呈酸性NH4Cl+H2ONH3·H2O+HCl平衡向右移动离子方程式:化学方程式:强酸弱碱盐NH4ClNaCl结论:对水的电离平衡无影响溶液显中性NaCl==Na++Cl-H2OOH-+H+强酸强碱盐盐溶液呈现不同酸碱性的原因思考与交流盐NaCl溶液NH4Cl溶液CH3COONa溶液盐的类别c(H+)c(OH-)相对大小溶液中的粒子有无弱电解质生成强酸强碱盐强酸弱碱盐弱酸强碱盐c(H+)=c(OH-)c(H+)>c(OH-)c(H+)∴溶液呈性碱⑵NaHSO3HSO3–+H2OH2SO3+OH–①②HSO3–+H2OSO32–+H3O+①水解②电离程度:<∴溶液呈性酸⑶NaH2PO4溶液呈弱酸性⑷Na2HPO4溶液呈弱碱性1.下列溶液pH小于7的是A、氯化钾B、硫酸铜C、硫化钠D、硝酸钡2.下列溶液能使酚酞指示剂显红色的是A.碳酸钾B.硫酸氢钠C.碳酸氢钠D.氯化铁3.下列离子在水溶液中不会发生水解的是A.NH4+B.SO42–C.Al3+D.F–4. 氯化铵溶液中离子浓度从大到小排列正确的是A.NH4+、H+、OH–、Cl–B.Cl–、NH4+、H+、OH–C.H+、Cl–、NH4+、OH–D.Cl–、NH4+、OH–、H+【课堂练习】哪些因素会影响盐类水解?同样为强碱弱酸盐溶液,CH3COONa、Na2CO3、NaHCO3.却表现出不同的碱性,这是为什么?讨论:五、影响盐类水解的因素五、影响盐类水解的因素1、内因:盐本身的性质。组成盐的酸或碱越弱,水解程度越大(越弱越水解)①不同弱酸对应的盐NaClO(aq)CH3COONa(aq)MgCl2(aq)AlCl3(aq)对应的酸HClOCH3COOH<>碱性②不同弱碱对应的盐对应的碱酸性Mg(OH)2Al(OH)3<>常见弱酸的酸性强弱H2SO3>H3PO4>HF>HCOOH>CH3COOH>H2CO3>H2S>HClO>C6H5-OH>HAlO21、内因:盐本身的性质。(越弱越水解)③同一弱酸对应的盐Na2CO3(aq)NaHCO3(aq)对应的酸HCO3–H2CO3<>碱性∴正盐的水解程度酸式盐的水解程度>④多元弱酸对应的酸式盐:NaHCO3、NaHS水解趋势电离趋势(NaH2PO4和NaHSO3相反)Na3PO4Na2HPO4NaH2PO4H3PO4Na2SO3Na2SO4NaHSO3NaHSO4pH值>>>>>>⑤弱酸弱碱盐:水解程度较大>2、外因:①温度:升温,促进水解。②浓度:加水稀释,促进水解。③加酸:弱碱阳离子的水解。弱酸根离子的水解。抑制促进④加碱:弱碱阳离子的水解。弱酸根离子的水解。促进抑制⑤加盐:加入与盐的水解性质相反的盐会促进盐的水解,相同则抑制已知在FeCl3稀溶液中存在如下水解平衡,Fe3++3H2OFe(OH)3+3H+通过实验探究促进或抑制FeCl3水解的条件.2、外界条件对水解平衡的影响-外因条件移动方向n(H+)c(H+)pH值Fe3+水解程度现象升温加水FeCl3HClNaOHNa2CO3加铁粉减小右移右移右移右移左移增大增大增大增大减小减小减小减小减小增大增大增大增大黄色变浅黄色加深黄色加深黄色变浅有红褐色沉淀及气体产生Fe3++3H2OFe(OH)3+3H+增大增大增大减小减小减小减小增大增大红褐色沉淀右移减小增大左移减小减小增大黄色变浅对于水解平衡CH3COO–+H2OCH3COOH+OH–改变条件方向c(Ac–)c(HAc)c(OH–)c(H+)pH水解程度升温加H2O加醋酸加醋酸钠通HCl(g)加NaOH2.影响因素因素对盐类水解程度的影响内因外因温度浓度外加酸碱外加盐组成盐的酸或碱越弱,水解程度越大升高温度能够促进水解盐溶液浓度越小,水解程度越大水解显酸性的盐溶液,加碱会促进水解,加酸会抑制水解,反之亦然加入与盐的水解性质相反的盐会促进盐的水解11、相同物质的量浓度的、相同物质的量浓度的NaXNaX、、NaYNaY、、NaZNaZ三三种溶液的种溶液的pHpH分别为分别为77、、88、、99,则相同物质的,则相同物质的量浓度的量浓度的HXHX、、HYHY、、HZHZ的酸性强弱顺序为的酸性强弱顺序为。。HX>HY>HZ练习:2、已知K(HNO2)>K(CH3COOH)>K(HClO),请推测NaClO、CH3COONa、NaNO2溶液pH由大到小的顺序是:。NaClO>CH3COONa>NaNO2相同条件,相同物质的量浓度的下列七种溶液:Na2CO3、NaClO、CH3COONa、Na2SO4、NaOH、(NH4)2SO4、NaHSO4,pH值由大到小的顺序为:NaOH>NaClO>Na2CO3>CH3COONa>Na2SO4>(NH4)2SO4>NaHSO4>7:<7:=7:已知K2HPO4溶液呈碱性,即HPO2-结合H+能力大于其电离H+的能力,下列操作能使该溶液中H+浓度增大的是()A.加水B.加热C.加消石灰D.加K2HPO4A混施化肥泡沫灭火剂制备胶体明矾净水判断溶液酸碱性离子浓度比较试剂贮存盐溶液的蒸发溶液配制盐类水解的应用六.盐类水解的应用六、盐类水解的应用:(一)易水解盐溶液的配制与保存:配制FeCl3溶液:加少量;配制FeCl2溶液:加少量;保存NH4F溶液:加相应的酸或碱稀盐酸稀盐酸和Fe粉不能存放在玻璃瓶中!铅容器或塑料瓶配制FeSO4溶液:加少量;稀硫酸和Fe粉(考点)Fe3++3H2OFe(OH)3+3H+(二)判断盐溶液的酸碱性:NaCl溶液CH3COONa溶液NH4Cl溶液中性碱性酸性CH3COONH4溶液中性NaHCO3溶液碱性NaHSO3溶液酸性NaH2PO4溶液酸性Na2HPO4溶液碱性(相同温度和浓度)(三)判定离子能否大量共存:Al3+与AlO2–Al3+与HCO3–Al3+与CO32–Al3+与S2–Al3++3AlO2–+H2OAl(OH)346Al3++3HCO3–Al(OH)3+3CO22Al3++3CO32–+3H2O2Al(OH)3+3CO22Al3++3S2–+6H2O2Al(OH)3+3H2S(四)盐作净化剂的原理:明矾、FeCl3等本身无毒,胶体可吸附不溶性杂质,起到净水作用。Al3++3H2OAl(OH)3(胶体)+3H+Fe3++3H2OFe(OH)3(胶体)+3H+(五)某些化肥的使用使土壤酸碱性变化(NH4)2SO4(硫铵)Ca(OH)2、K2CO3(草木灰)酸性碱性它们不能混合使用,否则会因双水解而降低肥效。农业谚语“灰混粪,粪混灰,灰粪相混损肥分。”KK22COCO33((草木灰的主要成分草木灰的主要成分))和和NHNH44ClCl混混合合弱酸阴离子和弱碱阳离子在溶液中不能大量共存(六)利用盐类水解除杂如:MgCl2溶液中混有FeCl3杂质。Fe3++3H2OFe(OH)3+3H+Mg2++2H2OMg(OH)2+2H+①加入Mg(OH)2②加入MgO③加入MgCO3④加入Mg不引入新杂质!(主)(次)热的纯碱去污能力更强,为什么?升温,促进CO32–水解。(七)纯碱溶液和肥皂水洗涤油污的原理.Na2CO3+H2ONaHCO3+NaOHC17H35COONa+H2OC17H35COOH+NaOH加热,促进水解,去污能力增强(八)制备某些无水盐,要考虑盐的水解(不能用蒸发溶液的方法制取)AlCl3溶液蒸干Al(OH)3灼烧Al2O3MgCl2·6H2OMg(OH)2MgO△△晶体只有在干燥的HCl气流中加热,才能得到无水MgCl2FeCl3溶液Fe(NO3)3溶液Fe2(SO4)3溶液CuSO4·5H2ONa2CO3·10H2ONa2CO3溶液Na2SO3溶液Ca(HCO3)2溶液Fe2O3Fe2O3Fe2(SO4)3Na2CO3Na2CO3CuSO4Na2SO4CaCO3下列盐溶液加热蒸干后,得到什么固体物质?(九)泡沫灭火器的原理塑料内筒装有Al2(SO4)3溶液外筒装有NaHCO3溶液Al2(SO4)3和NaHCO3溶液:Al3++3HCO3–Al(OH)3+3CO2Al3++3H2OAl(OH)3+3H+HCO3–+H2OH2CO3+OH–速度快耗盐少混合前混合后为什么不能把溶解度大的Na2CO3代替NaHCO3?原因是:等质量的Na2CO3、NaHCO3反应,Na2CO3产生的CO2少且生成CO2的速率慢。AlAl3+3++3HCO+3HCO33--═Al(OH)═Al(OH)33↓+3CO↓+3CO22↑↑2Al2Al3+3++3CO+3CO332-2-+3H+3H22O═2Al(OH)O═2Al(OH)33↓+3CO↓+3CO22↑↑七、水溶液中微粒浓度的大小比较:(考点)1、电离理论:②多元弱酸电离是分步,主要决定第一步①弱电解质电离是微弱的如:NH3·H2O溶液中:c(NH3·H2O)c(OH–)c(NH4+)c(H+)如:H2S溶液中:c(H2S)c(H+)c(HS–)c(S2–)c(OH–)>>>>>>>对于弱酸、弱碱,其电离程度小,产生的离子浓度远远小于弱电解质分子的浓度。2、水解理论:①弱离子由于水解而损耗。如:KAl(SO4)2溶液中:c(K+)c(Al3+)②水解程度微弱③多元弱酸水解是分步,主要决定第一步c(Cl–)c(NH4+)c(H+)c(NH3·H2O)c(OH–)如:Na2CO3溶液中:c(CO3–)c(HCO3–)c(H2CO3)>>>>>>>如:NH4Cl溶液中:七、水溶液中微粒浓度的大小比较:(考点)单水解程度很小,水解产生的离子或分子浓度远远小于弱离子的浓度。1、电荷守恒:溶液中阴离子和阳离子所带的电荷总数相等如:1mol/LNH4Cl溶液中阳离子:阴离子:NH4+H+Cl–OH–正电荷总数=负电荷总数c(NH4+)+c(H+)=c(Cl–)+c(OH–)盐溶液中的三大守恒【自我检测1】(1)CH3COONac(Na+)+c(H+)=c(CH3COO–)+c(OH–)(2)(NH4)2SO4c(NH4+)+c(H+)=c(SO42–)+c(OH–)2书写电荷守恒式必须注意:①准确判断溶液中离子的种类;②弄清离子浓度和电荷浓度的关系,即离子所带电荷量做系数。【自我检测1】(3)Na2CO3c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)2、物料守恒:是指某一元素的原始浓度应该等于该元素在溶液中各种存在形式的浓度之和。溶液中,尽管有些离子能电离或水解,变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不变的。如:1mol/L的Na2CO3溶液中Na2CO3==2Na++CO32–H2OH++OH–CO32–+H2OHCO3–+OH–HCO3–+H2OH2CO3+OH–根据c(Na):c(C)=2:1c(Na+)=2mol/Lc(C)=1mol/L根据碳守恒c(CO32–)+c(HCO3–)+c(H2CO3)=1mol/L∴c(Na+)=2[c(CO32–)+c(HCO3–)+c(H2CO3)]书写物料守恒式必须注意:①准确的判断溶液中中心元素存在的微粒形式;②弄清中心元素之间的角标关系。⒈ 含特定元素的微粒(离子或分子)守恒 ⒉ 不同元素间形成的特定微粒比守恒 如:Na2S溶液Na2S==2Na++S2–H2OH++OH–S2–+H2OHS–+OH–HS–+H2OH2S+OH–因此:c(Na+)==2[c(S2–)+c(HS–)+c(H2S)]∵c(Na+):c(S)=2:1【自我检测2】(1)CH3COONac(Na+)=c(CH3COO-)+c(CH3COOH)(2)NaHCO3c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)3、质子守恒:水电离出的H+存在形式各浓度之和与水电离出的OH-存在形式各浓度之和相等如:在Na2S溶液中:H2OH++OH–S2–+H2OHS–+OH–HS–+H2OH2S+OH–c(OH-)=c(H+)+c(HS-)+2c(H2S)书写质子守恒式必须注意:①由水电离产生的H+和OH―的存在形式;②弄清被结合的H+或OH―离子浓度和弱电解质分子浓度的关系.S2–HS–H2S如:NH4HCO3溶液中c(H+)+c(H2CO3)=c(NH3.H2O)+c(OH–)+c(CO32–)c(H+)-c(CO32–)+c(H2CO3)=c(NH3.H2O)+c(OH–)如:NaHCO3溶液中C(OH-)=C(H+)+C(H2CO3)-C(CO32-)【自我检测3】(1)NH4Clc(H+)=c(OH–)+c(NH3·H2O)(2)Na2CO3c(OH―)=c(H+)+c(HCO3―)+2c(H2CO3)【经验交流】盐溶液中三大守恒等式有何特点?书写或判断时有哪些需要注意的事项?①物料守恒溶液中某一组分的原始浓度应该等于它在溶液中各种存在形式的浓度之和②电荷守恒溶液中正负电荷总数相等③质子守恒水电离出的H+存在形式各浓度之和与水电离出的OH—存在形式各浓度之和相等【例1】写出CH3COONa溶液中的三个守恒Na+、CH3COO—、CH3COOH、H+、OH—物料守恒电荷守恒质子守恒[CH3COO—]+[CH3COOH]=[Na+][CH3COO—]+[OH—]=[Na+]+[H+][OH—]=[CH3COOH]+[H+]Na2CO3溶液中三个等式、一个不等式CNa++CH+=CHCO3-+COH-+2CCO32-1/2CNa+=CHCO3-+CCO32-+CH2CO3COH-=CHCO3-+2CH2CO3+CH+CNa+>CCO32->COH->CHCO3->CH+电荷守恒:物料守恒:质子守恒:离子浓度大小顺序:Na3PO4溶液中三个等式、一个不等式[Na+]=[PO43-]+[HPO42-]+[H2PO4-]+[H3PO4]13[Na+]+[H+]=[OH-]+3[PO43-]+2[HPO42-]+[H2PO4-][OH-]=[H+]+[HPO42-]+2[H2PO4-]+3[H3PO4]电荷守恒:物料守恒:质子守恒:离子浓度大小顺序:[Na+]>[PO43-]>[OH-]>[HPO42-]>[H2PO4-]>[H+]试分析Na2CO3、NaHCO3、NaHSO3中离子浓度的大小关系Na+>CO32->OH->HCO3->H2CO3>H+Na+>HCO3->OH->H2CO3>H+>CO32-C(Na+)>C(HSO3-)>C(H+)>C(SO32-)>C(OH-)>H2SO3混合溶液离子浓度大小的比较1、分子的电离程度大于相应离子的水解程度2、分子的电离程度小于于相应离子的水解程度0.1mol/L的NH4Cl溶液和0.1mol/L的氨水的混合溶液中0.1mol/L的NaCN溶液和0.1mol/L的HCN溶液的混合液中大展身手1、草酸是二元弱酸,草酸氢钾溶液呈酸性,在0.1mol/LKHC2O4溶液中,下列关系正确的是()A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)B.c(HC2O4-)+c(C2O42-)=0.1mol/LC.c(C2O42-)>c(H2C2O4)D.c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)CD大展身手2、表示0.1mol/LNaHCO3溶液中有关粒子浓度的关系正确的是()A、C(Na+)=C(HCO3―)+C(CO32―)+C(H2CO3)B、C(Na+)+C(H+)=C(HCO3―)+C(CO32―)+C(OH―)C、C(Na+)+C(H+)=C(HCO3―)+2C(CO32―)+C(OH―)D、C(OH-)=C(H+)+C(H2CO3)+C(HCO3-)AC-C(CO32―)3、室温下,0.1mol/LNa2S溶液中,下列关系式中不正确的是()A.c(S2―)+c(HS―)+c(H2S)=1/2c(Na+)B.c(HS―)+2(S2―)+c(OH―)=c(Na+)+c(H+)C.c(OH―)=2c(H2S)+c(H+)+c(HS―)D.c(HS―)+(S2―)+c(OH―)=c(Na+)D4.表示0.1mol/LNaHCO3溶液中有关微粒的浓度关系式正确的是()A.[Na+]>[HCO3-]>[CO32-]>[H+]>[OH-]B.[Na+]+[H+]=[HCO3-]+[OH-]+[CO32-]C.[OH-]=[HCO3-]+2[H2CO3]+[H+]D.[Na+]=[HCO3-]+[H2CO3]+2[CO32-]C5.将各10mL0.1mol/L的氨水和盐酸混合后,溶液中各粒子物质的量浓度关系不正确的是()A.C(Cl-)+C(OH-)=C(NH4+)+C(H+)B.C(Cl-)>C(NH4+)>C(H+)>C(OH-)C.C(NH4+)+C(NH3.H2O)+C(NH3)=0.1mol/LD.C(H+)=C(OH-)+2C(NH3.H2O)CD八、水解常数Kh



















