




《温度对化学平衡的影响PPT课件下载(共16页)》是由用户上传到老师板报网,本为文库资料,大小为612 KB,总共有16页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 16页
- 612 KB
- VIP模板
- ppt
- 数字产品不支持退货
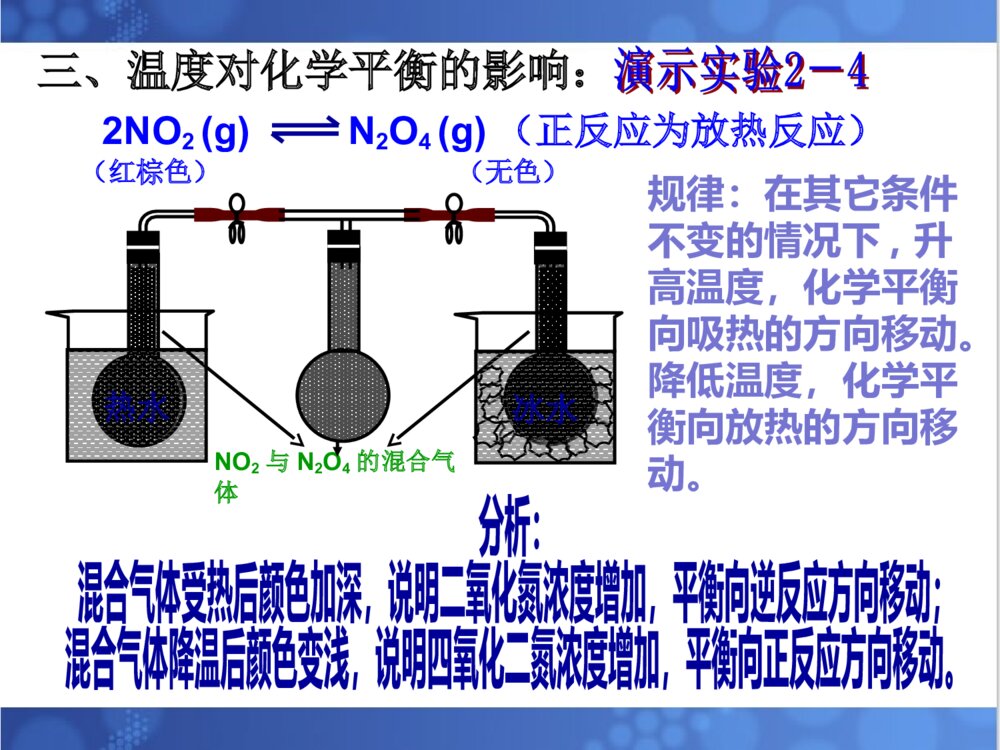
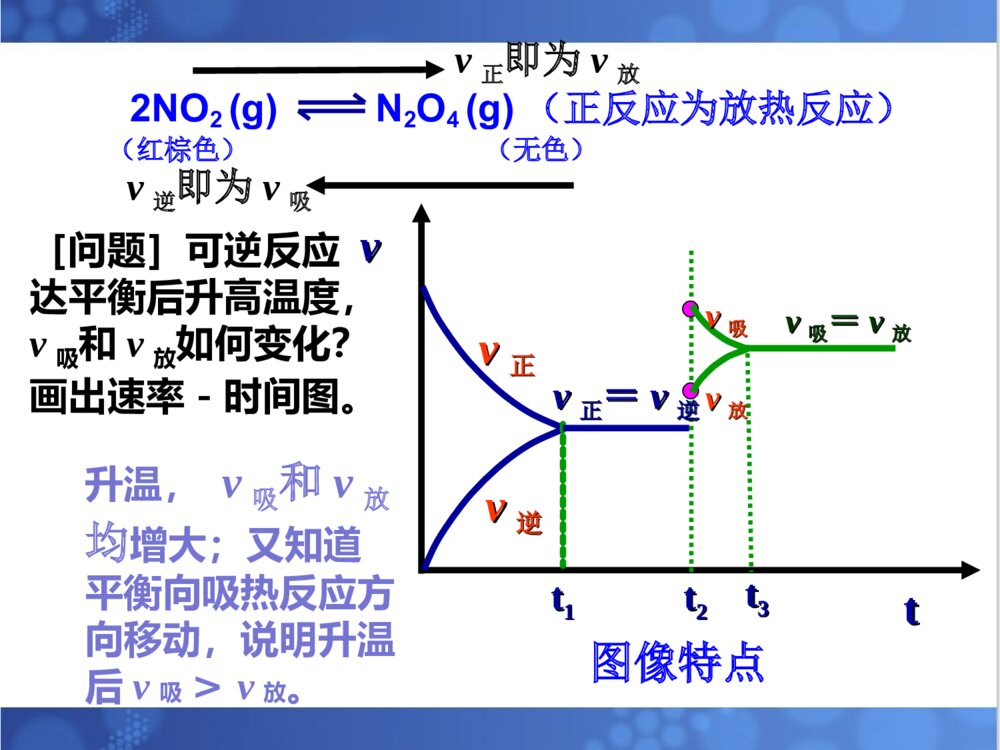
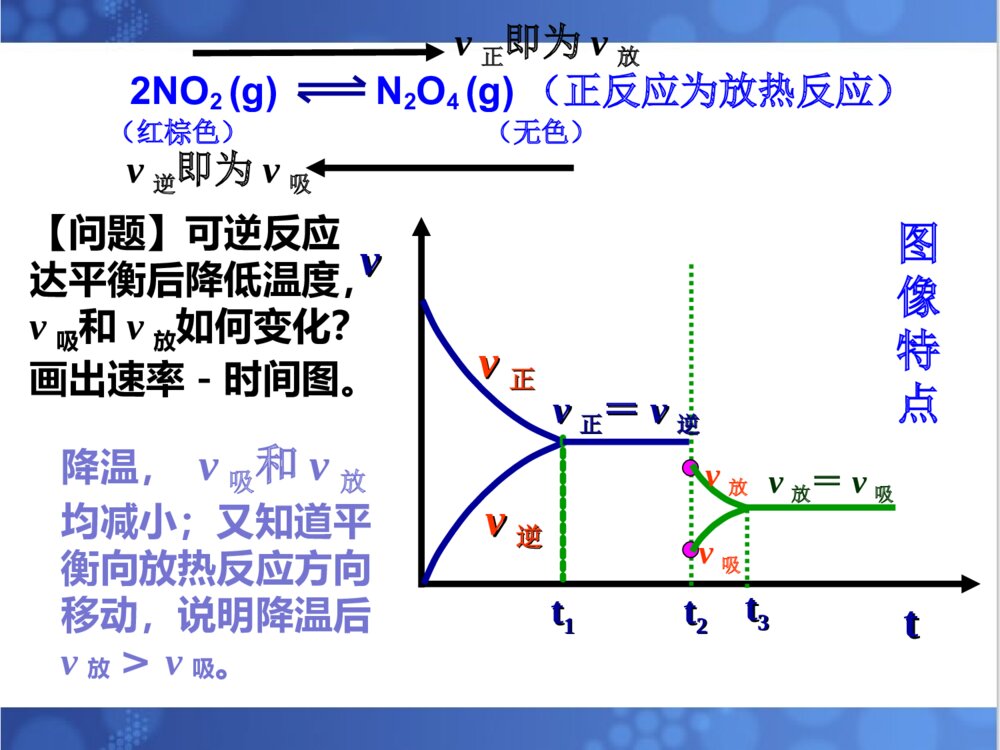
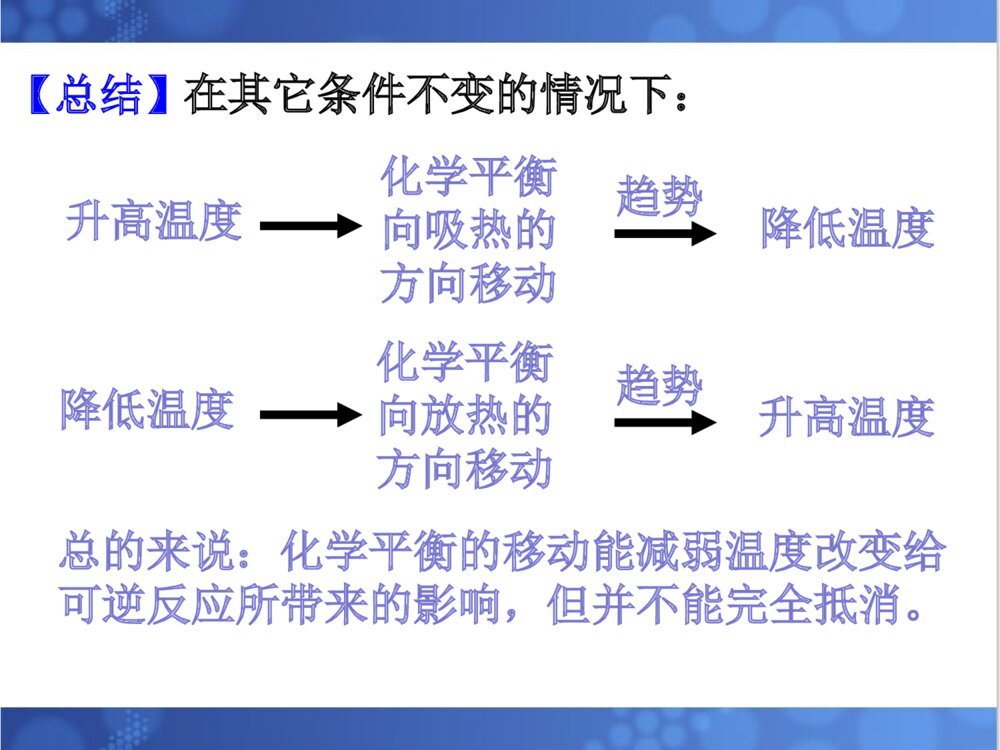
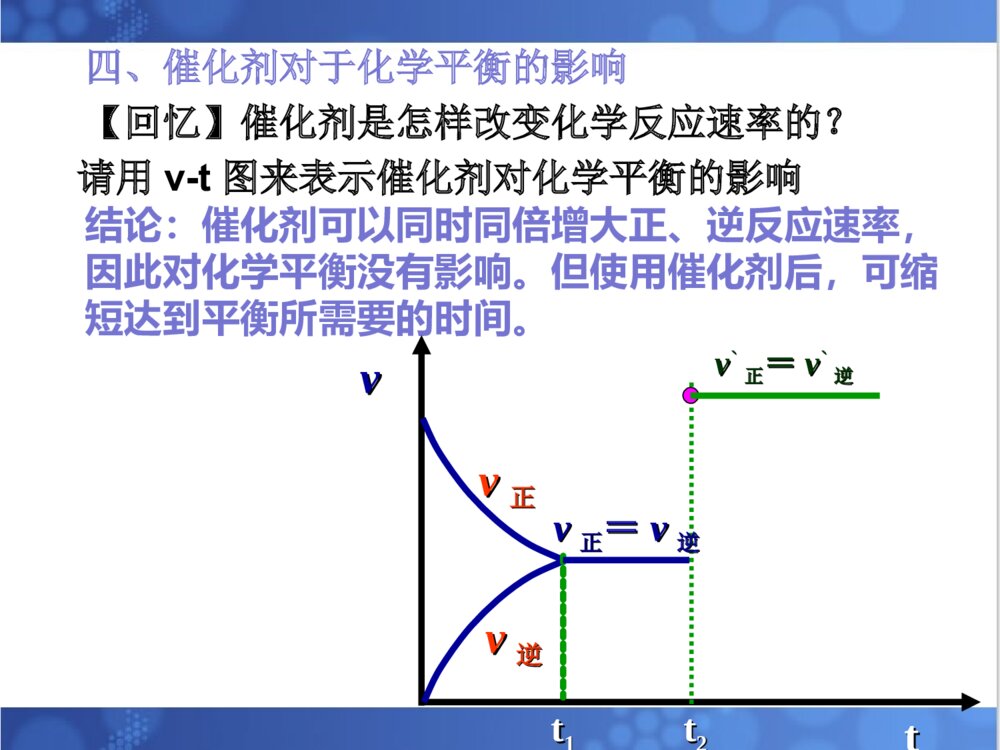
1.理解温度等条件对化学平衡的影响。2.理解化学平衡移动原理。3.培养自己尊重科学、严谨求学、勤于思考的态度。4.培养自己分析、推理、归纳、概括和总结的能力。温度等条件对化学平衡的影响。平衡移动原理。温度等条件对化学平衡的影响。平衡移动原理。解化学平衡题目时的注意事项:①分析反应物生成物是否均为气体,若全为气体,则气体质量守恒;若有固体出现;则气体质量不守恒且用压强变化判断反应前后系数大小关系时,不能出现固体物质的系数。②分析反应前后气体体积是否发生改变,若反应前后气体体积不变,则改变压强,化学平衡不移动;若反应前后气体体积不相等,则分析正反应是气体体积增大的方向还是减小的方向。③分析正反应是放热反应还是吸热反应。一、浓度对化学平衡的影响:在其它条件不变的情况下,增大反应物浓度或减小生成物的浓度平衡会向正反应方向移动;减小反应物浓度或增大生成物的浓度平衡会向逆反应方向移动。【复习】影响化学平衡的条件:注意事项:改变固体或纯液体物质的量对化学反应速率和化学平衡均无影响。总的来说:化学平衡的移动能减弱浓度改变给可逆反应所带来的影响,但并不能完全抵消。对于反应前后气体体积不相等的可逆反应,在其它条件不变时,增大压强,平衡向气体体积缩小的方向移动;减小压强,平衡向气体体积增大的方向移动。二、压强对化学平衡的影响:[问题]压强变化是如何引起化学平衡的移动的?P改变引起气体体积改变引起反应物、生成物浓度改变引起v缩小和v增大的变化,有可能引起平衡的移动。也可以把结论改为:在其它条件不变的情况下,压缩气体的体积,平衡向气体体积减小的方向移动;增大气体的体积,平衡向气体体积增大的方向移动。注意事项:①只适用于气体反应,对固、液体反应无影响②一般情况下,题目中只要不明确说明“体积不变”或“固定体积”,则改变压强时,体积变化,可直接用结论来判断。③对于反应前后气体体积不变的可逆反应,改变压强,化学平衡不移动。总的来说:化学平衡的移动能减弱压强改变给可逆反应所带来的影响,但并不能完全抵消。2NO2(g)N2O4(g)(正反应为放热反应)(红棕色)(无色)NO2与N2O4的混合气体冰水热水三、温度对化学平衡的影响:规律:在其它条件不变的情况下,升高温度,化学平衡向吸热的方向移动。降低温度,化学平衡向放热的方向移动。2NO2(g)N2O4(g)(正反应为放热反应)(红棕色)(无色)v正即为v放v逆即为v吸[问题]可逆反应达平衡后升高温度,v吸和v放如何变化?画出速率-时间图。vvttvv正正vv逆逆tt11tt22vv正正==vv逆逆tt33vv吸吸vv放放vv吸吸==vv放放升温,v吸和v放均增大;又知道平衡向吸热反应方向移动,说明升温后v吸>v放。图像特点2NO2(g)N2O4(g)(正反应为放热反应)(红棕色)(无色)v正即为v放v逆即为v吸【问题】可逆反应达平衡后降低温度,v吸和v放如何变化?画出速率-时间图。降温,v吸和v放均减小;又知道平衡向放热反应方向移动,说明降温后v放>v吸。vvttvv正正vv逆逆tt11tt22vv正正==vv逆逆tt33v放v吸v放=v吸图像特点【总结】升高温度降低温度化学平衡向放热的方向移动化学平衡向吸热的方向移动降低温度升高温度趋势趋势总的来说:化学平衡的移动能减弱温度改变给可逆反应所带来的影响,但并不能完全抵消。在其它条件不变的情况下:四、催化剂对于化学平衡的影响【回忆】催化剂是怎样改变化学反应速率的?请用v-t图来表示催化剂对化学平衡的影响结论:催化剂可以同时同倍增大正、逆反应速率,因此对化学平衡没有影响。但使用催化剂后,可缩短达到平衡所需要的时间。vvttvv正正vv逆逆tt11tt22vv正正==vv逆逆vv``正正==vv``逆逆2SO2(g)+O2(g)2SO3(g)(正反应为放热反应)条件的改变平衡移动的方向新平衡建立时具体增大O2浓度O2浓度较原平衡()减小SO3浓度SO3浓度较原平衡()增大压强总压强比原平衡()升高温度平衡温度比原平衡()概括1.平衡移动原理对所有的动态平衡都适用。2.局限性:平衡移动原理可以判断平衡移动的方向,但不能判断建立新平衡所需的时间、以及在平衡建立过程中隔物质间的数量关系。2NO2N2O4(正反应放热)1、已知NO2能形成二聚分子现在要测定NO2的相对分子质量,应采用的适宜条件为()A、高温低压B、低温高压C、低温低压D、高温高压A2、反应2A(g)2B(g)+E(g)(正反应吸热)达到平衡时,要使反应向正反应方向移动,应采用的措施是()A、加压B、减压C、加入正催化剂D、升温BD3、反应:2A(g)2B(g)+E(g)(反应吸热)达到平衡时,要使正反应速率下降,A的浓度增大,应采用的措施是()A、加压B、减压C、减小E的浓度D、降温Dv’正vtv正v逆v’逆v’正=v’逆4、有反应aA+bBcC+dD其中反应物与生成物均为气体,达到平衡后其他条件不变,改变压强,则下图适合哪种情况()A、a+bc+d,加压C、a+bc+d,减压B【小结】【作业】



















