






《生物化学 第二章 蛋白质化学式课件PPT下载》是由用户上传到老师板报网,本为文库资料,大小为4.93 MB,总共有72页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 72页
- 4.93 MB
- VIP模板
- ppt
- 数字产品不支持退货
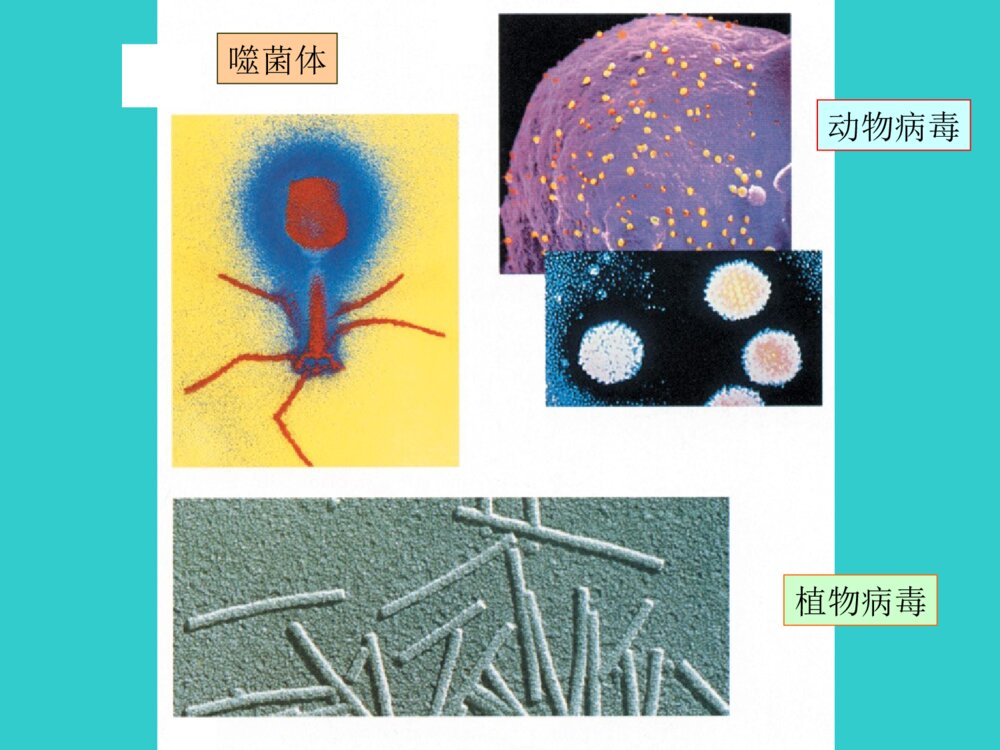
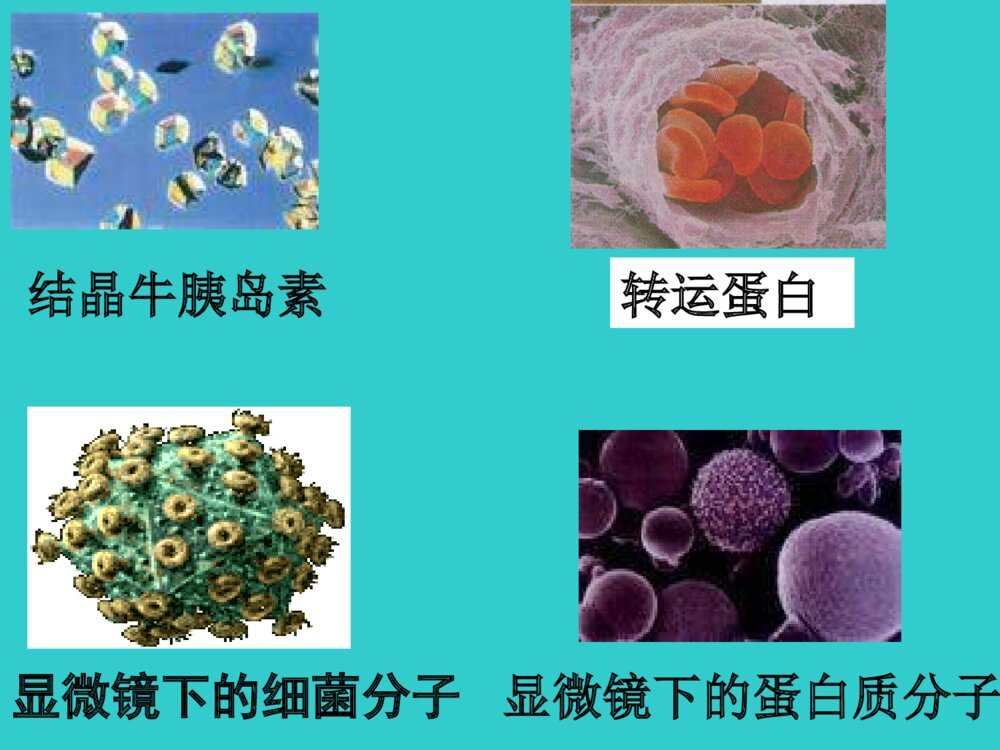
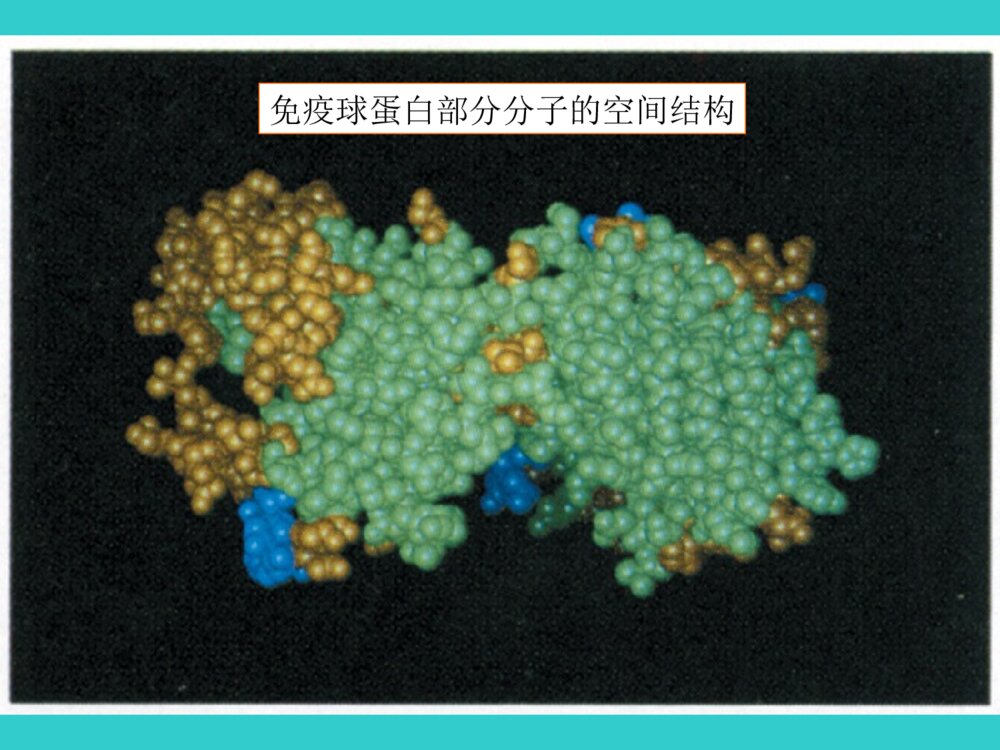
生物化学BiochemistryBiochemistry第二章 蛋白质化学蛋白质普遍存在蛋白质普遍存在于生物界于生物界蛋白质分布广泛、功能多样•1.催化功能-酶•2.结构功能-皮、毛、骨、牙、细胞骨架•3.载运功能-膜蛋白•4.调控功能-激素如胰岛素组蛋白•5.运动功能-鞭毛、肌肉蛋白•6.防御功能-免疫球蛋白•7.接受和传递信息视色素味觉蛋白45噬菌体动物病毒植物病毒显微镜下的蛋白质分子结晶牛胰岛素显微镜下的细菌分子转运蛋白免疫球蛋白部分分子的空间结构蛋白质在生物体内具有广泛和重要的生理功能(生老病死)•生(诞生、生长):在蛋白质(酶)控制(催化)下的老细胞计划性凋亡和新细胞的再生(细胞新陈代谢)、活细胞物质的代谢。•老?蛋白质功能的普遍衰退。•病——个别蛋白质的功能障碍。•死?蛋白质功能的全部停止,分解。•是生命的物质基础第一节蛋白质的化学组成•一、蛋白质的元素组成蛋白质主要含有C、H、O、N以及S元素。N元素是蛋白质的特征元素,根据对大多数蛋白质的N元素分析,其质量百分含量相近,一般在13-19%,平均为16%。所以1克氮相当于6.25克蛋白质。这是19世纪后期丹麦人约翰凯达尔发明的。方法原理是:用强酸处理样品,让蛋白质中的氮元素释放出来,测定氮的含量,就可以算出蛋白质的含量。把测出的氮含量乘以6.25,就是蛋白质含量。实际工作中:凯氏定氮测定蛋白质含量三聚氰胺•三聚氰胺:C3H6N6,俗称密胺、蛋白精,IUPAC命名为“1,3,5-三嗪-2,4,6-三氨基”微溶于水,常温下,在水中的溶解度仅为0.33%•可用于装饰面板、涂料、模塑粉、纸张处理剂等方面•含氮量为66%左右。•按照凯氏定氮法,每克三聚氰胺可测得4.125克“粗蛋白”。•所以不法商人才在奶粉中加入三聚氰胺冒充蛋白质,以提升食品检测中的蛋白质含量指标三聚氰胺的检测方法HPLC高效液相色谱法、GC-MS气相色谱质谱联用法、LC-MS-MS检测定量限分别为2mg/kg、0.05mg/kg、0.01mg/kg二、蛋白质的基本组成单位——氨基酸•氨基酸(Aminoacids,AA)是蛋白质的基本组成单位•构成蛋白质的氨基酸有20种•是生物界组成蛋白质的通用氨基酸19(一)氨基酸的结构同分异构现象构造异构constitutional立体异构Stereo-碳链异构(如:丁烷/异丁烷)官能团异构(如:醚/醇)位置异构(如:辛醇/仲辛醇)构型异构configurational构象异构conformational顺反(Z/E)异构光学异构(对映异构)同分异构isomerism手性——实物与其镜像不能完全重合的特性手性分子(S)-(+)-乳酸(R)-(-)-乳酸CCOOHHHOCH3CCOOHH3COHH——具有手性特征的分子•透视式•纽曼投影式•楔形式HHHHHHHHHHHHCOOHCOHCH3H费歇尔投影式HOCOOHCH3HHOCOOHHCH3[规定]投影时,与手性碳相连横向两个键朝前,竖向两个键向后,交叉点为手性碳。含碳原子的原子团在竖立的方向上,同时要尽可能把最高氧化态的基团放在上面,即命名编号最小的碳原子放在上端。顺序法则除甘氨酸外,其他所有构成蛋白质的α-氨基酸都是L-型的。L-氨基酸的结构通式αα碳原子碳原子,,不对称碳原子不对称碳原子侧链侧链二十种氨基酸二十种氨基酸除除GlyGly外全是外全是L-L-构型构型表2-1氨基酸的结构和分类WJUZBOX20种氨基酸的发现年代表(二)氨基酸的分类•1、按照R的性质分类--+++SS有大有小有正有负有极性非极性形形色色的氨基酸側基(1)非极性疏水氨基酸甘氨酸丙氨酸缬氨酸亮氨酸异亮氨酸脯氨酸苯丙氨酸(2)极性中性氨基酸天冬酰胺谷氨酰胺酪氨酸色氨酸(3)酸性氨基酸天冬氨酸谷氨酸(4)碱性氨基酸赖氨酸精氨酸2、根据营养价值分类必需氨基酸人体所需的八种赖氨酸(Lys)缬氨酸(Val)蛋氨酸(Met)色氨酸(Try)亮氨酸(Leu)异亮氨酸(Ile)酪氨酸(Thr)苯丙氨酸(Phe)婴儿时期所需:精氨酸(Arg)、组氨酸(His)早产儿所需:色氨酸(Try)、半胱氨酸(Cys)(三)氨基酸的理化性质•1、两性电离与等电点(pI)COOHNH2H+COO-R-C-HNH2H+R-C-HCOO-NH2R-C-H酸性环境中性环境碱性环境+1-10pK1~2pK2~9.4等电点6.0等电点(isoelectricpoint,pI)分子呈电中性时的溶液的分子呈电中性时的溶液的pHpH值。值。2、茚三酮反应:茚三酮反应:除Pro生成黄色化合物外,其它AA生成蓝紫色化合物(570nm);用途:常用于氨基酸的定性或定量分析。CCCOOO茚三酮CCCOOOHOHH2OH2O水合茚三酮CO2NH2RCHO++++CCCOOHOHH2NCHCOOHRCCCOOOHOH+2NH3CCCOOCCCOO-NH4+NH2O2++CCCOOOCCCOOHHO•氨基酸组分全自动分析仪三、蛋白质分子中氨基酸的连接方式•(一)肽键和肽CHCH2NOHOR1CHCNOHOR2H2HH脱水缩合-OHH--HOH-CHCH2NOR1CHCNOHOR2HH2O肽键二肽•肽键一个氨基酸的氨基和另一个氨基酸的羧基缩水而成的酰氯键,为蛋白质分子中的主要共价键由两个氨基酸组成的肽称为二肽由几个到十个氨基酸组成的肽称为寡肽由十个以上氨基酸组成的肽则称为多肽多肽和蛋白质分子中的的氨基酸单元称为氨基酸残基。51三.生物活性肽几乎所有生物体内部都存在多种非蛋白质肽。这类物质都有相应的生物活性。通常统称为生物活性肽。生物活性肽是目前生命科学研究的热点领域之一。生物活性肽在组成、结构和大小方面存在很大的差异。•如:脑啡肽;激素类多肽;抗生素类多肽;谷胱甘肽;蛇毒多肽等。•谷胱甘肽G-SH•抗氧化、解毒,用于重金属、丙烯腈、氟化物、一氧化碳及有机溶剂等中毒•促甲状腺激素释放激素(TRH)•为下丘脑中促垂体激素的一种。•由谷氨酸,组氨酸及脯氨酸结合成三肽•主要作用于腺垂体促进促甲状腺激素(TSH)释放55“阿斯巴甜”•甜味剂•甜味是蔗糖的200倍•二肽•适用于糖尿病患者•目前安全性有争议(二)多肽链•多个氨基酸经肽键连接而成的链状结构称为多肽链•有开链和环状肽•在多肽链中,氨基酸残基按一定的顺序排列,这种排列顺序称为氨基酸顺序。CCNCCNCCNCCNCCH2CHCH2CH2CH2COO-OHCO2HCH2CONH2OHCH3H3N+OOOOHHHHHHHHHSerValTyrAspGlnCH3N-¶ËC-¶Ëëļü•方向性:一条多肽链有两个末端,自由-氨基,称为氨基端或N-端;游离-羧基,称为羧基端或C-端。主链侧链•氨基酸的顺序:N-端→C-端•如上述五肽可表示为:Ser-Val-Tyr-Asp-Gln丝氨酰缬氨酰酪氨酰天冬氨酰谷氨酸第二节蛋白质的分子结构•化学结构:一级结构•空间结构(高级结构):二级结构三级结构四级结构一、蛋白质的一级结构•(一)蛋白质一级结构的概念•指多肽链中氨基酸(残基)的排列顺序。•含有二硫键也包括生成二硫键的半胱氨酸残基位置•是蛋白质分子中由肽键相连的基本分子结构•是区分不同蛋白质最基本、最重要的标志之一(二)一级结构是空间结构的基础•决定了多肽链中氨基酸R侧链的位置•R侧链的大小性质决定肽链折叠、盘曲形成的空间结构和功能•一级结构决定其空间结构•不同空间结构和生理功能的分子基础•一级结构由DNA分子上相应核苷酸序列即遗传信息决定•不同生物具有不同遗传物质DNA•编码合成出不同的蛋白质•物种的分子基础二、蛋白质的空间结构•蛋白质分子中各个原子、各个基团在三维空间的相对位置。•决定蛋白质性质和功能的结构基础(一)维持蛋白质空间结构的化学键•共价键•次级键•氢键盐键疏水键范德华引力•二级结构氢键•三级结构疏水键•四级结构氢键盐键•又称盐桥或离子键,是蛋白质分子中正、负电荷的侧链基团互相接近,通过静电吸引而形成的,如羧基和氨基、胍基、咪唑基等基团之间的作用力。吸引力F与电荷电量的乘积成正比,与电荷质点间的距离平方成反比,在溶液中此吸引力随周围介质的介电常数增大而降低。在近中性环境中,蛋白质分子中的酸性氨基酸残基侧链电离后带负电荷,而碱性氨基酸残基侧链电离后带正电荷,二者之间可形成离子键。盐键的形成不仅是静电吸引而且也是熵增加的过程。升高温度时盐桥的稳定性增加,盐键因加入非极性溶剂而加强,加入盐类而减弱。•是多肽链上的某些氨基酸的疏水基团或疏水侧链(非极性侧链)由于避开水而造成相互接近、粘附聚集在一起。它在维持蛋白质三级结构方面占有突出地位.疏水键作用: 蛋白质分子中许多氨基酸的疏水侧链有形成疏水键的倾向, 由于疏水效应,这些疏水残基常被水驱入蛋白质分子内总聚集 成簇,带动肽链盘曲折叠,对蛋白质三、四级结构的形成和稳 定起重要作用。 疏水键又称疏水作用力。不是真正的化学键 疏水键(hydrophobicbond)是两个不溶于水的分子间的相互作用。当分子中烃基链与水接触时,因不能被水溶剂化,界面水分子整齐地排列,导致系统熵值降低,能量增加,产生表面张力。为了克服表面张力,疏水基团会收缩、卷曲和结合,将原来规则排布于表面的水分子排挤出,使疏水表面减少,转换出的水分子呈无序态,熵值回升,焓变值减少,从而降低系统能量。这种非极性的烃基链因能量效应和熵效应等热力学作用是疏水基团在水中的相互结合作用成为疏水键。•次级键由蛋白质分子的主、侧链上的极性、非极性基团和离子基团相互作用而形成的•键能小而多•在维持蛋白质严密空间结构和生理功能上非常重要•二硫键属于共价键,加固由次级键维系的蛋白质分子严密的空间结构(二)蛋白质的二级结构的概念及类型Pauling1950年,Pauling提出蛋白质二级结构的a-螺旋(2)由一条或几条肽链通过化学键连接在一起,螺旋、折叠、盘曲形成复杂的空间结构。



















