








《高中化学选修4 《第二章化学反应速率和化学平衡 第三节 化学平衡》PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为907.2 KB,总共有50页,格式为pptx。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 50页
- 907.2 KB
- VIP模板
- pptx
- 数字产品不支持退货
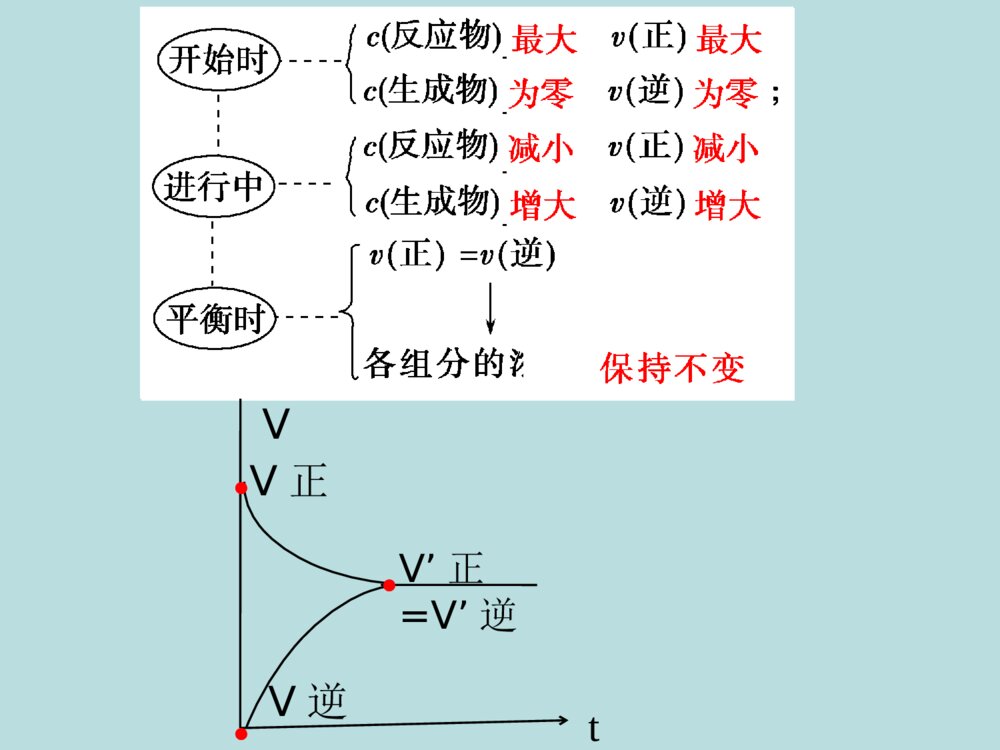
第三节化学平衡第二章化学反应速率和化学平衡一、可逆反应正反应:从左向右进行的反应。逆反应:从右向左进行的反应。在同一条件下向正反应方向进行的同时又向逆反应方向进行的反应.用表示。例:H2+I22HI可逆反应的特点:⑴同一条件下正、逆反应同时进行⑵可逆反应通常不能进行到底,反应物的转化率不能达到100%,反应体系中得到的总是反应物与生成物的混合物。tVV正V逆V’正=V’逆●●●1、定义在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态就是化学平衡状态。注意三点前提(适用范围):可逆反应内在本质:v(正)=v(逆)≠0外在标志:反应混合物中各组分的浓度保持不变二、化学平衡状态如何判断可逆反应是否达到平衡状态?可逆反应2、化学平衡状态的特征(3)动:动态平衡,v(正)=v(逆)≠0(2)等:(4)定:(1)逆:(5)变:v(正)=v(逆)反应混合物中各组分的浓度保持不变条件改变,原平衡被破坏,在新的条件下建立新的平衡a、同一物质V消耗=V生成b、不同物质一正一逆速率之比等于计量数之比(1)v正=v逆3、判断反应是否达到平衡的依据(3)还可以延伸至混合气体的总压强、总体积、混合气体的颜色、密度、平均摩尔质量等不随时间的延长而改变(2)反应混合物中各组分的浓度(百分含量)保持不变。注意:某一可变物理量不再随时间改变而改变即表明达到平衡状态。(变量不变达平衡)1、在一定温度下,可逆反应A(g)+3B(g)2C(g)达到平衡的标志是( )A.C的生成速率与C的分解速率相等B.单位时间生成nmolA,同时生成3nmolBC.单位时间生成B的速率,与生成C的速率相等D.单位时间生成nmolA,同时生成2nmolCAD练习:2、下列说法可以证明反应N2+3H22NH3已达平衡状态的是()A.1个N≡N键断裂的同时,有3个H-H键形成B.1个N≡N键断裂的同时,有3个H-H键断裂C.1个N≡N键断裂的同时,有6个N-H键断裂D.1个N≡N键断裂的同时,有6个N-H键形成AC3、下列说法中可以充分说明反应:P(g)+Q(g)R(g)+S(g),在恒温恒容下已达平衡状态的是( )(A)P、Q、R、S的浓度不再变化(B)P、Q、R、S的分子数比为1:1:1:1(C)反应容器内气体总物质的量不再变化(D)混合气体的压强不再变化(E)气体的平均分子量不再变化(F)各组分的质量分数不再改变(G)混合气体的密度不再变化AF4、下列说法中可以充分说明反应:在恒温恒容下已达平衡状态的是( )(A)P、Q、R、S的浓度不再变化(B)P、Q、R、S的分子数比为2:1:1:1(C)反应容器内气体总物质的量不再变化(D)混合气体的压强不再变化(E)气体的平均分子量不再变化(F)各组分的质量分数不再改变(G)混合气体的密度不再变化2P(g)+Q(g)R(g)+S(g)ACDEF5、在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应:A(s)+3B(g)2C(g)+D(g)已达平衡状态的是(其中只有B气体有颜色)()A.混合气体的压强B.混合气体的密度C.气体的平均分子量D.气体的颜色BCDA(g)+3B(g)2C(g)+D(g)?A(g)+3B(g)2C(g)+2D(g)?ACDD6、在一个不传热的固定容积的密闭容器中有可逆反应:mA(g)+nB(g)pC(g)+qQ(g),当m、n、p、q为任意整数时,一定可以作为达到平衡的标志是: ①体系的压强不再改变②体系的温度不再改变 ③各组分的浓度不再改变④各组分的质量分数不再改变 ⑤反应速率Va:Vb:Vc:Vd=m:n:p:q ⑥单位时间内mmolA断键反应,同时pmolC也断键反应 (A)③④⑤⑥ (B)②③④⑥ (C)①③④⑤ (D)①③④⑥B【复习】化学平衡状态的定义:在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态就是化学平衡状态。化学平衡的特征:逆等动定变——可逆反应(可逆过程)——V正=V逆(不同的平衡对应不同的速率)——动态平衡。(V正=V逆≠0)——平衡时,各组分浓度、含量保持不变(恒定)——条件改变,原平衡被破坏,在新的条件下建立新的平衡可逆反应中,旧平衡的破坏、新平衡的建立过程叫做化学平衡的移动旧化学平衡V(正)=V(逆)组分含量保持恒定平衡破坏条件改变V(正)≠V(逆)组分含量发生变化新化学平衡一定时间后组分含量保持新恒定①v(正)>v(逆),平衡向右移动②v(正)V逆V逆>V正增大反应物浓度vtt1t20V(正)V(逆)t3增大生成物浓度vtt1t20V(正)V(逆)V`(逆)V`(正)t3减小生成物浓度vt1t20V(正)V(逆)V`(正)V`(逆)tt3减小反应物浓度vt1t20V(正)V(逆)V`(逆)V`(正)t3t其他条件不变时,改变反应物和生成物的浓度的速率-时间图像V`(正)·V`(逆)·2、温度对化学平衡的影响实验2-72NO2(气)N2O4(气)H=-56.9kJ/mol△(红棕色)(无色)在其它条件不变的情况下,升高温度,平衡向吸热反应方向移动降低温度,平衡向放热反应方向移动结论:注意:在其它条件不变的情况下,升高温度,不管是吸热反应还是放热反应,反应速率都增大,反之,降低温度,不管是吸热反应还是放热反应,反应速率都减慢。温度对反应速率的影响是双向影响,但是吸热反应对温度的变化更敏感!!!(1)当正反应为放热反应时VÕýVÄæVÕý=VÄæV/ÕýV/Õý=V/ÄæV/Äæ·´Ó¦¹ý³Ì·´Ó¦ËÙÂÊVÕýVÄæVÕý=VÄæV/ÕýV/Õý=V/ÄæV/Äæ·´Ó¦¹ý³Ì·´Ó¦ËÙÂÊ(a)升高温度(b)降低温度mA(g)+nB(g)pC(g)VÕýVÄæVÕý=VÄæV/ÕýV/Õý=V/ÄæV/Äæ·´Ó¦¹ý³Ì·´Ó¦ËÙÂÊVÕýVÄæVÕý=VÄæV/ÕýV/Õý=V/ÄæV/Äæ·´Ó¦¹ý³Ì·´Ó¦ËÙÂÊmA(g)+nB(g)pC(g)(2)当正反应为吸热反应时VÕýVÄæVÕý=VÄæV/ÕýV/Õý=V/ÄæV/Äæ·´Ó¦¹ý³Ì·´Ó¦ËÙÂÊtVÕýVÄæVÕý=VÄæV/ÕýV/Õý=V/ÄæV/Äæ·´Ó¦¹ý³Ì·´Ó¦ËÙÂÊt(a)升高温度(b)降低温度mA(g)+nB(g)pC(g)VÕýVÄæVÕý=VÄæV/ÕýV/Õý=V/ÄæV/Äæ·´Ó¦¹ý³Ì·´Ó¦ËÙÂÊtVÕýVÄæVÕý=VÄæV/ÕýV/Õý=V/ÄæV/Äæ·´Ó¦¹ý³Ì·´Ó¦ËÙÂÊtmA(g)+nB(g)pC(g)3、催化剂对化学平衡的影响:同等程度改变化学反应速率,V’正=V’逆,只改变反应到达平衡所需要的时间,而不影响化学平衡的移动。V(molL-1S-1)V正=V逆t1T(s)0V’正=V’逆催化剂对可逆反应的影响:改变反应条件平衡移动①③增大反应物浓度减小反应物浓度升高温度降低温度增大生成物浓度减小生成物浓度向减少反应物的浓度方向移动向减少生成物的浓度方向移动向吸热反应方向移动向增大反应物的浓度方向移动向增大生成物的浓度方向移动向放热反应方向移动浓度、温度对化学平衡的影响平衡移动原理(勒夏特列原理)如果改变影响平衡的一个条件(如浓度或温度等),平衡就向能够减弱这种改变的方向移动。①此原理只适用于已达平衡的体系②移动的结果只能是减弱外界条件的改变量,但不能抵消。注意:压强对化学平衡的影响例如:N2(g)+3H2(g)2NH3(g)450。C时N2与H2反应生成NH3的实验数据压强/MPa15103060100NH3/%2.09.216.435.553.669.4由勒夏特列原理推知压强对化学平衡的影响为:压强增大,平衡向气体体积减小的方向移动压强减小,平衡向气体体积增大的方向移动2NO2(g)N2O4(g)(红棕色)(无色)加压前后颜色有什么变化?为什么?压强引起平衡移动的相关图象⑴当a+b>c+d时:Vt0V(正)V(逆)V(正)V(逆)Vt0V(正)V(逆)V(逆)V(正)①增大压强②减小压强对于反应aA(g)+bB(g)cC(g)+dD(g)⑵当a+b<c+d时:Vt0V(正)V(逆)V(逆)V(正)③增大压强④减小压强Vt0V(正)V(逆)V(正)V(逆)思考:对于反应H2O+COH2+CO2如果增大压强,反应速率是否改变,平衡是否移动?高温催化剂速率-时间关系图:V(molL-1S-1)t(s)0V正=V逆V’正=V’逆增大压强,正逆反应速率均增大相同的倍数,V’正=V’逆,平衡不移动。t2下列反应达到化学平衡时,增大压强,平衡是否移动?向哪个方向移动?移动的根本原因是什么?①2NO(g)+O2(g)2NO2(g)②CaCO3(s)CaO(s)+CO2(g)③H2O(g)+C(s)CO(g)+H2(g)④H2O(g)+CO(g)CO2(g)+H2(g)⑤H2S(g)H2(g)+S(s)不移动不移动1、对任何一个平衡体系,采取下列措施一定引起平衡移动的是A.加入一种反应物B.增加体系的压强C.升高温度D.使用催化剂C练习2、当人体吸入较多量的一氧化碳时,就会引起一氧化碳中毒,这是由于一氧化碳跟血液里的血红蛋白结合。使血红蛋白不能很好的跟氧气结合,人因缺少氧气而窒息,甚至死亡。这个反应可表示为:血红蛋白-O2+CO血红蛋白-CO+O2运用化学平衡移动的理论,简述抢救一氧化碳中毒患者时可以采取什么措施?3、可逆反应H2O(g)+C(s)CO(g)+H2(g)在一定条件下达平衡状态,改变下列条件,能否引起平衡移动的是?CO产率有何变化?①增大H2O(g)浓度②加入更多的C(S)③增加H2浓度4、在高温下,反应(正反应为吸热反应)要使混合气体颜色加深,可采取的方法是A、保持容积不变,加入HBr(g)B、降低温度C、升高温度D、保持容积不变,加入H2(g)AC2HBr(g)H2(g)+Br2(g)5、恒温下,反应aX(g)bY(g)+cZ(g)达到平衡后,把容器体积压缩到原来的一半且达到新平衡时,X的物质的量浓度由0.1mol/L增大到0.19mol/L,下列判断正确的是:A.a>b+cB.a<b+cC.a=b+cD.a=b=cA序号起始时浓度mol/L平衡时浓度mol/L平衡时c(H2)c(I2)c(HI)c(H2)c(I2)c(HI)K1①0.01060.011900.001830.003120.0176754.498②0.01130.0090400.003560.001250.0155954.618③000.01060.001140.001140.0084154.329K2④0.01130.0090400.004560.001950.008598.298⑤000.01650.003390.003390.009778.306⑥000.01250.002580.002580.007428.272在K1(698.6℃),K2(798.6℃)时的可逆反应I2(g)+H2(g)2HI(g)根据表中平衡时的值,分析其中规律。其它平衡体系的数据进行分析,都有类似的关系。(1)K与反应的起始浓度大小无关;(2)K与起始物质无关,与正向建立平衡还是逆向建立平衡无关,即与平衡建立的过程无关。(3)温度不变时,K是常数,温度改变,K值改变分析上表,你得出什么结论?(4)K不受压强的影响四、化学平衡常数1、定义在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数叫做该反应的化学平衡常数(简称平衡常数)。用K表示平衡常数。2、表达式及单位cp(C)·cq(D)cm(A)·cn(B)K=mA+nBpC+qDC:各组分的平衡浓度 K的单位为(mol·L-1)n(n=p+q-m-n)1/2N2(g)+3/2H2(g)NH3(g)N2(g)+3H2(g)2NH3(g)2NH3(g)N2(g)+3H2(g)K1=K22=1/K3结论:平衡常数的表达式与方程式的书写方式有关。FeO(s)+CO(g)Fe(s)+CO2(g))()(2COcCOcKCr2O72-(aq)+H2O(l)2CrO42-(aq)+2H+(aq))()(2COcCOcK注意:(3)固体、纯液体浓度,一般不出现在表达式中,表达式中只包括气态物质和溶液中各溶质的浓度。水蒸气要写(2)同一反应,系数不同,K值不同(1)必须指明温度,浓度为平衡状态时的浓度。(1)K值越大,表示反应进行的程度越大,反应物转化率也越大。3、化学平衡常数的应用衡量化学反应进行的程度(2)一般当K>105时,该反应进行得基本完全。K<10-5认为正反应很难进行(逆反应较完全)【应用一】平衡常数表示反应进行的程度,不表示反应的快慢,即速率大,K值不一定大对于反应mA(g)+nB(g)pC(g)+qD(g)随温度的升高其反应的平衡常数有以下变化,请判断Ⅰ和Ⅱ两种情况哪种是吸热,哪种是放热?温度平衡常数ⅠⅡ若升高温度,K值增大,则正反应为吸热反应若升高温度,K值减小,则正反应为放热反应【应用二】利用K值可判断反应的热效应对于可逆反应:mA(g)+nB(g)pC(g)+qD(g)Qc>k,未达平衡,逆反应方向进行。Qc=k,达平衡Qc



















