





《《化学反应热的计算》人教版高中化学教学PPT课件》是由用户上传到老师板报网,本为文库资料,大小为948.5 KB,总共有50页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 50页
- 948.5 KB
- VIP模板
- ppt
- 数字产品不支持退货
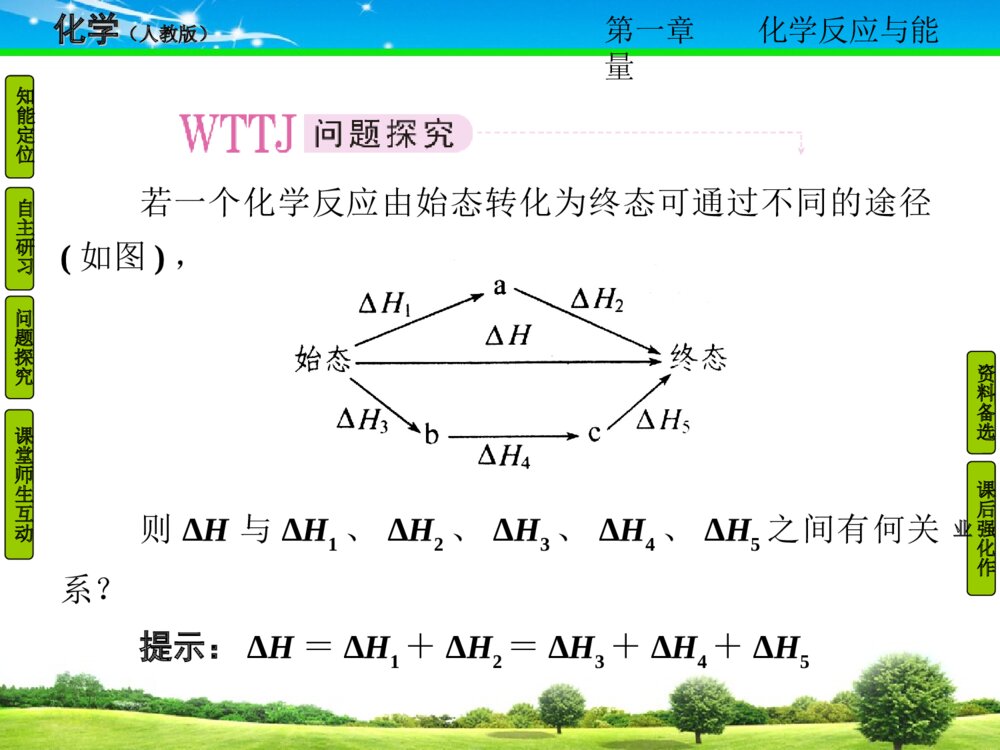
第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动第三节 化学反应热的计算第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动1.理解反应热、燃烧热的概念,能对反应热进行简单的计算。2.理解盖斯定律,并能用该定律处理一些实际问题。第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动一、盖斯定律1.内容:不管化学反应是一步或________完成,其反应热是________的。或者说,化学反应的反应热只与反应体系的________和________有关,而与反应的________无关。2.解释:能量的释放或吸收是以________的物质为基础的,二者密不可分,但以________为主。第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动3.应用:对于进行得________的反应,不容易________的反应,________(即有________)的反应,________反应热有困难,如果应用________,就可以________地把它们的反应热计算出来。例如:C(s)+O2(g)=CO(g)上述反应在O2供应充分时,可燃烧生成CO2;O2供应不充分时,虽可生成CO,但同时还部分生成CO2。因此该反应的ΔH________。但是下述两个反应的ΔH却可以直接测得:第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动(1)C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1(2)CO(g) +O2(g)=CO2(g)ΔH2=-283.0kJ·mol-1根据盖斯定律,就可以计算出欲求反应的ΔH。分析上述两个反应的关系,即知:ΔH1=________,ΔH=________。则C(s)与O2(g)生成CO(g)的热化学方程式为________________________________________________________________________。第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动二、反应热的计算反应热计算的主要依据是________、________和________的数据。答案:一、1.分几步 相同 始态 终态 途径2.发生变化 物质3.很慢 直接发生 产品不纯 副反应发生 测定 盖斯定律 间接 无法测得ΔH2+ΔH ΔH1-ΔH2C(s)+1/2O2(g)=CO(g) ΔH=-110.5kJ·mol-1二、热化学方程式 盖斯定律 燃烧热第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动若一个化学反应由始态转化为终态可通过不同的途径(如图),则ΔH与ΔH1、ΔH2、ΔH3、ΔH4、ΔH5之间有何关系?提示:ΔH=ΔH1+ΔH2=ΔH3+ΔH4+ΔH5第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动1.盖斯定律(1)内容:不管化学反应是一步完成或分几步完成,其反应热是相同的,换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动说明:如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热相同。第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动2.运用盖斯定律解题的一般方法(1)虚拟路径法若反应物A变为生成物D,可以有两个途径a.由A直接变成D,反应热为ΔH;b.由A经过B变成C,再由C变成D,每步的反应热分别为ΔH1、ΔH2、ΔH3。如图所示:则有:ΔH=ΔH1+ΔH2+ΔH3第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动(2)加合法即运用所给方程式通过加减的方法得到所求热化学方程式。(3)实例如已知下列两个热化学方程式:①P4(s,白磷)+5O2(g)=P4O10(s)ΔH1=-2983.2kJ/mol②P(s,红磷)+ΔH2=-738.5kJ/mol第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动要写出白磷转化为红磷的热化学方程式可虚拟如下过程。第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动根据盖斯定律ΔH=ΔH1+(-ΔH2)×4=-2983.2kJ/mol+738.5kJ/mol×4=-29.2kJ/mol所以白磷转化为红磷的热化学方程式为P4(s,白磷)=4P(s,红磷) ΔH=-29.2kJ/mol也可由①-4×②得白磷转化为红磷的热化学方程式为:P4(s,白磷)=4P(s,红磷) ΔH=-29.2kJ/mol第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动3.运用盖斯定律计算反应热时的注意事项(1)热化学方程式同乘以某一个数时,反应热数值也必须乘上该数。(2)热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减。(3)将一个热化学方程式颠倒时,ΔH的“+”“-”号必须随之改变。第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动【例1】 氢气和氧气生成液态水的反应,可以通过两种途径来完成,如图所示:已知:H2(g)+O2(g)=H2O(l) ΔH=-285.8kJ/molH2O(g)=H2O(l) ΔH2=-44.0kJ/mol求:H2(g)+O2(g)=H2O(g)的反应热ΔH1。第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动[解析] 本题型应用“加合法”解决,方便迅速,根据盖斯定律:ΔH=ΔH1+ΔH2,所以ΔH1=ΔH-ΔH2=-285.8kJ/mol-(-44.0kJ/mol)=-241.8kJ/mol。[答案] ΔH1=-241.8kJ/mol[点评] 根据盖斯定律,一个化学反应无论是一步完成还是分几步完成,反应焓变是一样的。因此,利用已知焓变求未知焓变的方法为:若一个化学方程式可由另外几个方程式相加减而得到,则该化学反应的焓变即为这几个变化焓变的代数和。对热化学方程式之间进行数学方法处理是盖斯定律的必然结果,这就是数学在化学中的应用,自然科学是相通的。第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动实验中不能直接测出由石墨和氢气生成甲烷反应的ΔH,但可测出下边几个反应的热效应:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3 kJ·mol-1①C(石墨)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1②H2(g)+1/2O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1③根据盖斯定律求反应C(石墨)+2H2(g)=CH4(g)④的ΔH4第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动[解析] 方法一:因为反应式①②③和④之间有以下关系:②+③×2-①=④所以ΔH4=ΔH2+2ΔH3-ΔH1=-393.5+2×(-285.8)-(-890.3)=-74.8(kJ·mol-1)方法二:也可以设计一个途径,使反应物经过一些中间步骤最后回复到产物:第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动可见ΔH4=ΔH2+2ΔH3-ΔH1=-74.8kJ·mol-1[答案] -74.8kJ·mol-1第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动1840年,瑞士化学家盖斯提出了化学反应的热效应仅与反应物的最初状态及生成物的最终状态有关,而与其中间步骤无关。按此规律,结合下述反应方程式,回答问题。已知:(1)NH3(g)+HCl(g)=NH4Cl(s)ΔH=-176kJ·mol-1(2)NH3(g)+H2O(l)=NH3·H2O(aq)ΔH=-35.1kJ·mol-1(3)HCl(g)+H2O(l)=HCl(aq)ΔH=-72.3kJ·mol-1第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动(4)NH3(aq)+HCl(aq)=NH4Cl(aq)ΔH=-52.3kJ·mol-1(5)NH4Cl(s)+2H2O=NH4Cl(aq) ΔH=Q则第(5)个方程式中的反应热是______________________________________________________________。第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动[解析] 考查盖斯定律的理解运用。本题可用“加合法”,也可用“虚拟路径法”。a.加合法(4)+(3)+(2)-(1)与(5)相比较得反应热得+16.3kJ·mol-1。b.虚拟路径法设计反应的虚拟过程则有:-35.1kJ/mol+(-72.3kJ/mol)+(-52.3kJ/mol)+176kJ/mol=ΔH,ΔH=+16.3kJ/mol第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动[答案] +16.3kJ·mol-1[点评] 利用盖斯定律结合已知反应的反应热可以求解一些相关反应的反应热。解此类题关键是善于设计合理的反应过程,适当加减已知方程式及反应热。第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一。煤转化为水煤气的主要化学反应为:C+H2O(g)CO+H2。C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1①H2(g)+O2(g)=H2O(g) ΔH2=-242.0kJ·mol-1②CO(g) +O2(g)=CO2(g) ΔH3=-283.0kJ·mol-1③第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动试回答:(1)请你根据以上数据,写出C(s)与水蒸气反应生成CO和H2的热化学方程式:________________________________________________________________________。(2)比较反应热数据可知,1mol CO(g)和1mol H2(g)完全燃烧放出的热量之和比1mol C(s)完全燃烧放出的热量________(填“多”或“少”)。甲同学据此认为:“煤炭燃烧时加少量水,可以使煤炭燃烧放出更多的热量。”第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动乙同学根据盖斯定律作出了下列循环图:第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动请你写出ΔH1、ΔH2、ΔH3、ΔH4之间存在的关系式:______________________________。乙同学据此认为:“将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同。”请分析:甲、乙两同学观点正确的是________(填“甲”或“乙”)同学,另一同学出现错误观点的原因是______________________________________________。(3)请分析将煤转化为水煤气再燃烧有哪些优点?__________________________________________。第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动[解析] (2)1mol CO和1mol H2共放热:Q1=242.0kJ+283.0kJ=525.0kJ 1mol C放热Q2=393.5kJ,Q1>Q2。由于反应热只与始态和终态有关,与途径无关,所以ΔH1=ΔH2+ΔH3+ΔH4。由能量守恒可知,乙同学的观点正确,因为虽然由②比较的数据得出1mol CO和1mol H2放热比1mol C放热多,但甲同学违背了能量守恒,忽略了C(s)+H2O(g)=CO(g)+H2(g)为吸热反应。(3)将煤转化为水煤气再燃烧,一方面提高了燃烧效率,另一方面减少了污染。第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动[答案] (1)C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.5kJ·mol-1 (2)多 ΔH1=ΔH2+ΔH3+ΔH4 乙 甲同学忽视了反应C(s)+H2O(g)=CO(g)+H2(g)为吸热反应 (3)将煤转化为水煤气后,一个优点是燃料更易充分燃烧,提高了燃烧效率,减少了能源的浪费;另一个优点是在燃料燃烧过程中减少了二氧化硫、粉尘与污染物的排放。第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动1.依据(1)热化学方程式与数学上的方程式相似,可以移项同时改变正负号,各项的化学计量数包括ΔH的数值可以同时扩大或缩小相同的倍数。(2)根据盖斯定律,可以将两个或两个以上的热化学方程式包括其ΔH相加或相减,得到一个新的热化学方程式。(3)可燃物完全燃烧产生的热量=可燃物的物质的量×其燃烧热第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动(4)根据反应物和生成物的化学键断裂所吸收的能量,ΔH=反应物的化学键断裂所吸收的能量和-生成物的化学键断裂所吸收的能量。(5)根据反应物和生成物的总能量计算ΔH=E生成物-E反应物(6)根据比热公式进行计算:Q=cmΔt第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动2.注意事项(1)反应热数值与各物质的化学计量数成正比,因此热化学方程式中各物质的化学计量数改变时,其反应热数值需同时做相同倍数的改变。(2)热化学方程式中的反应热是指反应按所给形式完全进行时的反应热。(3)正、逆反应的反应热数值相等,符号相反。(4)求总反应的反应热,不能不假思索地将各步反应的反应热简单相加。不论一步进行还是分步进行,始态和终态完全一致,盖斯定律才成立。某些物质只是在分步反应中暂时出现,最后应该恰好消耗完。第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动●案例精析【例2】 25℃、101kPa时,将1.0g钠跟足量的氯气反应,生成NaCl晶体并放出17.87kJ的热量,求生成1mol NaCl的反应热。[解析] 方法一 Na与Cl2起反应的化学方程式如下:Na(s)+Cl2(g)=NaCl(s)1mol Na反应后生成1mol NaCl的摩尔质量是23g /mol ,设生成1mol NaCl的反应热为x。1.0g:23g/ mol=-17.87kJ:x x=-411.01kJ/mol第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动方法二 据Na元素守恒,生成的NaCl晶体时放出17.87kJ的热量。则生成1mol NaCl晶体时放热17.87kJ·g-1×23g·mol-1=411.01kJ/mol。[答案] -411.01kJ·mol-1[点评] 计算化合反应的反应热时,可根据化学方程式去计算或者根据元素守恒去计算。第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动已知下列反应的反应热:ΔH3=-285.8kJ/mol试计算下述反应的反应热:2C(s)+2H2(g)+O2(g)=CH3COOH(l)第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动[解析] 将①式反写为2CO2(g)+2H2O(l)=CH3COOH(l)+2O2(g)ΔH′1=870.3kJ/mol④将②×22C(s)+2O2(g)=2CO2(g)ΔH′2=-787kJ/mol③×22H2(g)+O2(g)=2H2O(l)ΔH′3=-571.6kJ/mol以上三式相加得:2C(s)+2H2(g)+O2(g)=CH3COOH(l) ΔH=-571.6kJ/mol-787kJ/mol+870.3kJ/mol即ΔH=-488.3kJ/mol。第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动[答案] 反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为-488.3kJ/mol。[点评] 应用盖斯定律计算反应热时应注意:①热化学方程式同乘以某一个数时,反应热数值也必须乘上该数。②热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减。③将一个热化学方程式左右颠倒时,ΔH的“+”“-”号必须随之改变。第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动某液化石油气由丙烷和丁烷组成,其质量分数分别为80%和20%。它们燃烧的热化学方程式分别为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(g)ΔH=-2200kJ·mol-12C4H10(g)+13O2(g)=8CO2(g)+10H2O(g)ΔH=-5800kJ·mol-1有一质量为0.8kg、容积为4.0L的铝壶,将一壶20℃的水烧开需消耗该液化石油气0.056 kg。试计算该燃料的利用率。已知水的比热容为4.2kJ/(kg·℃),铝的比热为0.88kJ/(kg·℃)。第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动[解析] 由热化学方程式可知,1mol C4H10燃烧放热2900kJ。0.056kg液化石油气完全燃烧放出的热量为:将水烧开所需热量为:Q=cm(t-t0)=[4.2×4+0.88×0.8]×(100-20)=1400(kJ)第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动[答案] 50%[点评] 求解时应用了反应热与物理学热容知识的关系,解题的关键是不要遗漏铝壶升温时要吸收热量。第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动已知热化学方程式:C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1 CaCO3(g)=CaO(s)+CO2(s) ΔH=+178.2kJ·mol-1若要将1t碳酸钙煅烧成生石灰,求理论上需要不含杂质的焦炭的质量。第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动[解析] 碳酸钙分解所需要的能量由焦炭的燃烧提供。首先求出1t碳酸钙分解需要吸收的热量x,然后计算多少焦炭燃烧放出的热量为x。设煅烧1t CaCO3需热量为x:CaCO3(s)=CaO(s)+CO2(g) ΔH=+178.2kJ·mol-1100g 178.2kJ1×106g x解得:x=178.2×104kJ。第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动设要燃烧放出178.2×104kJ的能量,需焦炭的质量为m(假设焦炭完全燃烧):C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-112g 393.5kJm 178.2×104kJ解得m≈54.3×103g,故需焦炭54.3kg。[答案] 54.3kg第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动人类能源的新希望可燃冰的学名为“天然气水合物”,是天然气在0℃和30个大气压的作用下结晶而成的“冰块”。“冰块”里甲烷占80%~99.9%,可直接点燃,燃烧后几乎不产生任何残渣,污染比煤、石油、天然气都要小得多。西方学者称其为“21世纪能源”或“未来能源”。1立方米可燃冰可转化为164立方米的天然气和0.8立方米的水。科学家估计,海底可燃冰分布的范围约4000万平方千米,占海洋总面的10%,海底可燃冰可供人类使用1000年。第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动随着研究和勘测调查的深入,世界各国的海洋中发现的可燃冰逐渐增加,1993年海底发现57处,2001年增加到88处。据探查估算,美国东南海岸外的布莱克海岭,可燃冰资源量多达180亿吨,可满足美国105年的天然气消耗;日本海及其周围可燃冰资源可供日本使用100年以上。据专家估计,全世界石油总储量在2700亿吨到6500亿吨之间。按照目前的消耗速度,再有50~60年,全世界的石油资源将消耗殆尽。可燃冰的发现,让陷入能源危机的人类看到了新的希望。第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动【例】 据报道,我国南海海底发现巨大的“可燃冰”带,能源总量估计相当于我国石油总量的一半;而我国东海“可燃冰”的蕴藏量也很可观……“可燃冰”的主要成分是一水合甲烷晶体(CH4·H2O)。请结合所学化学知识回答下列问题:(1)下列说法中正确的是(填序号)________。A.CH4·H2O晶体中水是溶剂B.CH4·H2O的组成元素有三种C.CH4·H2O中CH4和H2O的质量比为1:1D.“可燃冰”能燃烧,说明水具有可燃性第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动E.“可燃冰”有可能成为人类未来的重要能源F.“可燃冰”是一种比较洁净的能源G.“可燃冰”提供了水可能变成油的例证H.“可燃冰”的主要可燃成分是甲烷(2)可燃冰的发现为我国在新世纪使用高效能源开辟了广阔的前景。你认为能开发利用的新能源还有(至少填写两种)________、________。第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动[解析] (1)溶剂是能够溶解其他物质的物质,溶剂与溶质间没有固定的组成,而CH4·H2O的组成固定,故A项不正确。CH4中含C、H两种元素,H2O中含有H、O两种元素,故CH4·H2O由C、H、O三种元素组成,B项正确,CH4·H2O分子中CH4与H2O的物质的量之比为1∶1,而其相对分子质量不等,则C项不正确。CH4·H2O可燃是由于能分解产生CH4,故D项不正确。H2O是不可能变成油的,故G项不正确。(2)新能源是指以新技术为基础,系统开发利用的能源,包括太阳能、生物质能、风能、地热能、氢能源等。第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动[答案] (1)BEFH (2)太阳能 潮汐能(或水能、风能、核能、地热能、氢能等)第一章化学反应与能量化学化学(人教版)(人教版)问题探究知能定位课后强化作业资料备选自主研习课堂师生互动



















